题目内容
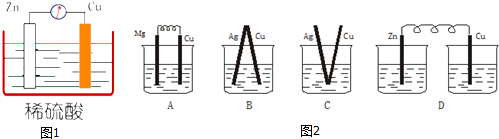
9.在金属晶体中,根据影响金属键的因素判断下列各组金属熔沸点高低顺序,其中正确的是( )| A. | Mg>Al>Ca | B. | Al>Na>Li | C. | Al>Mg>Ca | D. | Mg>Ba>Al |
分析 在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高,据此分析解答.
解答 解:在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高,
A.价电子数Al>Mg=Ca,原子半径Ca>Mg>Al,所以金属熔沸点:Al>Mg>Ca,故A错误;
B.价电子数Al>Li=Na,原子半径Na>Al>Li,元素金属熔沸点Al>Li>Na,故B错误;
C.价电子数Al>Mg=Ca,原子半径Ca>Mg>Al,所以金属熔沸点:Al>Mg>Ca,故C正确;
D.价电子数Al>Mg=Ba,原子半径Ba>Mg>Al,所以金属熔沸点:Al>Mg>Ba,故D错误;
故选C.
点评 本题考查金属晶体熔沸点高低判断,为高频考点,明确金属晶体熔沸点高低影响因素是解本题关键,熟练掌握原子半径大小规律,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
19.下列叙述中不正确的是( )
| A. | 电解池的阳极上发生氧化反应,阴极上发生还原反应 | |
| B. | 原电池跟电解池连接后,电子从原电池负极流向电解池阴极 | |
| C. | 电镀时,电镀池里的阳极材料发生氧化反应 | |
| D. | 电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气 |
17.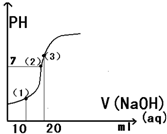 常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )
常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )
 常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )
常温下,用0.1mol/L的氢氧化钠溶液滴定20ml0.1mol/L醋酸溶液,所得滴定曲线如图所示,下列说法正确的是 ( )| A. | 点(1)所示溶液中:C(CH3COOH)+C(H+)=C(CH3COO-)+C(OH-) | |
| B. | 点(2)所示溶液中:C(Na+)=C(CH3COO H )+C(CH3COO-) | |
| C. | 点(3)所示溶液中:C(Na+)>C(OH-)>C(CH3COO-)>C(H+) | |
| D. | 滴定过程中可能出现:C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-) |
4.近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品.苹果酸(α羟基丁二酸)是这种饮料的主要酸性物质,其结构如图所示:
下列相关说法正确的是( )

下列相关说法正确的是( )
| A. | 1mol苹果酸在一定条件下能与足量钠反应生成3mol氢气 | |
| B. | 苹果酸在一定条件下能催化氧化生成醛 | |
| C. | 苹果酸在一定条件下能发生加聚反应生成高分子化合物 | |
| D. | 1 mol苹果酸与NaHCO3溶液反应最多消耗2 mol NaHCO3 |
14.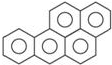 苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )
苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )
 苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )
苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )| A. | 10,30 | B. | 10,32 | C. | 11,30 | D. | 11,32 |
1.下列实验装置图完全正确的是( )
| A. | 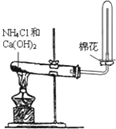 实验室制取并收集氨气 | B. | 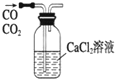 除去CO中混有的CO2 | ||
| C. | 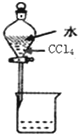 分离水和CCl4的混合物 | D. | 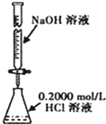 酸碱中和滴定 |
1.下图是元素周期表的一部分,针对表中的①~⑩种元素,用元素符号或化学式回答相关问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为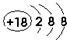 .
.
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
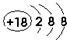 .
.(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2.
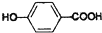
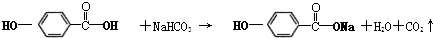 ,
,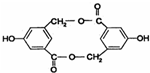 ,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.
,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.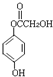 等(只写一种).
等(只写一种).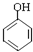 .
.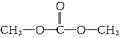 .
.