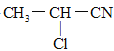题目内容
【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。
【答案】2△H-△H1 3.75×10-3molL-1min-1 < 容器乙反应速率快,所以T1>T2,又因为容器乙平衡时n(Cl2)大,说明温度升高,平衡逆向移动,△H2<0》 E 0.33或![]() < 0.6
< 0.6
【解析】
(1)根据盖斯定律进行计算;
(2)①由表中数据可知,0~80min内,容器甲中消耗氯气1.8mol,则由方程式可知消耗0.6mol氨气,结合![]() 计算;
计算;
②容器乙达到平衡用时少,则反应快,温度高,容器乙中平衡时n(Cl2)较大,说明升高温度平衡逆向移动,则正反应为放热反应;
④温度为T1时,达到平衡消耗2.4mol氯气,结合方程式计算;该温度下,若改为初始体积为2L的可变容器,则压强大于恒容时;
⑤计算平衡时各物质的浓度,可计算平衡常数。
(1)已知Ⅰ.![]()
![]() ;
;
Ⅱ.![]()
![]() ;根据盖斯定律2×Ⅰ-Ⅱ可得
;根据盖斯定律2×Ⅰ-Ⅱ可得![]() ,所以
,所以![]() =2△H-△H1,
=2△H-△H1,
故答案为:2△H-△H1
(2))①由表中数据可知,0~80min内,容器甲中消耗氯气1.8mol,则由方程式可知消耗0.6mol氨气,则![]() =3.75×10-3molL-1min-1
=3.75×10-3molL-1min-1
故答案为:3.75×10-3molL-1min-1;
②容器乙达到平衡用时少,则反应快,温度高,容器乙中平衡时n(Cl2)较大,说明升高温度平衡逆向移动,则正反应为放热反应,
故答案为:<;容器乙反应速率快,所以T1>T2,又因为容器乙平衡时n(Cl2)大,说明温度升高,平衡逆向移动,△H2<0;
③A.按1:1投入反应物,按1:3反应,无论任何时候,都不能满足![]() ,故A错误;
,故A错误;
B.根据图表可知达到平衡的时间在40到80min之间,无法确定反应进行到70min时是否达到平衡,故v正不一定大于v逆,故B错误;
C.由极限法考虑可知当4molNH3和4molCl2完全反应时容器内的平均相对分子质量减小,所以容器内气体平均相对分子质量在增大,说明平衡在逆向移动,故C错误
D.加入液体,平衡不移动,故错误;
E.达平衡后,按原投料比再充入一定量反应物,相当于增大压强,平衡正向移动,则平衡后NH3的转化率增大,故D正确;
故答案为:E;
④温度为T1时,
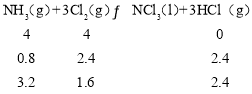
则HCl的体积分数为2.4/(3.2+1.6+2.4)=1/3,反应向体积减少的方向进行,如在恒容条件下,则压强减小,该温度下,若改为初始体积为2L的可变容器,则压强大于恒容时,平衡时容器中n(Cl2)<1.6mol,
故答案为:0.33或![]() ;<;
;<;
⑤温度为T2时

体积为2L,则K=![]() =0.6
=0.6
故答案为:0.6;

 名校课堂系列答案
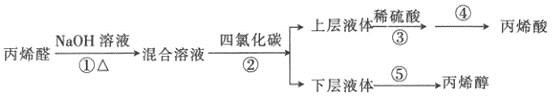
名校课堂系列答案【题目】丙烯酸是合成丙烯酸脂的原料,丙烯醇用于生产甘油、塑料等。某小组以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:
 已知反应原理:
已知反应原理:![]()
![]()
有关物质的物理性质如表:
| 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | -87 | -129 | 13 | -22.8 |
密度/gcm-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和 有机物 | 溶于水和 有机溶剂 | 溶于水和 有机溶剂 | 难溶于水, 易溶于有机物 |
(1)已知苯的沸点为80.1℃,上述步骤②的萃取剂用四氯化碳而不用苯,其主要原因可能是_________________。上层液体分液漏斗________(填“上”或“下”)口倒(或放)出。
(2)从步骤④的残留液中可提取一种无水正盐,它是________(填化学式)。
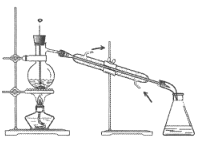
(3)步骤⑤采用如图装置,该装置有一处明显错误,请指出错误:________,并改之。收集丙烯醇的温度应控制在________左右。
(4)已知:醛类具有较强还原性,能与溴水、酸性高锰酸钾溶液、银氨溶液等反应。某同学为了证明丙烯酸产品中含有丙烯醛,设计如下方案:
a.取少量溴水于试管,加入适量丙烯酸样品,振荡,溶液褪色
b.取少量酸性高锰酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液褪色
c.取少量银氨溶液于试管,加入适量丙烯酸样品,用水浴加热,有银镜产生
d.取少量酸性重铬酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液由橙红色变成绿色
上述方案中,能证明丙烯酸产品中含少量丙烯醛的是________(填字母)。
(6)为了证明丙烯酸是弱酸,设计如下方案,其中能达到实验目的的是________(填字母)。
代号 | 方案 | 预测现象 |
A | 取少量 | 溶液变红色 |
B | 常温下,将10ml0.1molL-1NaOH溶液和10ml0.1molL-1 | pH>7 |
C | 用相同的导电仪分别测定盐酸溶液、 | 前者灯泡较亮 |