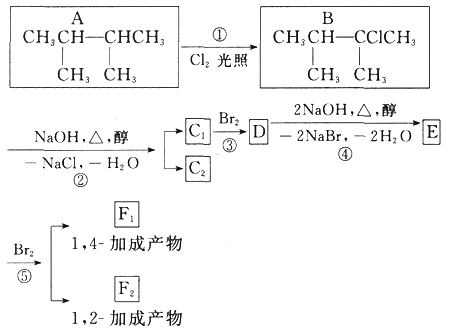
��Ŀ����
����Ŀ��̼�ǵ���������������������Ԫ��֮һ�����γɵ��ʼ��仯������������Ԫ�ء�
(1)̼ԭ�Ӻ�����________�ֲ�ͬ�ռ��˶�״̬�ĵ��ӡ�
(2)̼Ԫ�����γɶ������
��CO![]() �����幹����______________���以Ϊ�ȵ������������_________________��
�����幹����______________���以Ϊ�ȵ������������_________________��
��MgCO3�ֽ��¶ȱ�CaCO3�͵�ԭ����_________________________��
(3)̼�����⡢����������Ԫ�ع��ɻ�����CO(NH2)2���÷����и�Ԫ�صĵ縺���ɴ�С��˳��Ϊ________������Cԭ�ӵ��ӻ���ʽΪ_______��������������ˮ����Ҫԭ����________________��
(4)CO��̼Ԫ�صij����������N2��Ϊ�ȵ����壬��CO�ĽṹʽΪ________
(5)ͼΪ̼����һ��ͬ����������ʯ�ľ���������ԭ���������ΪA(0��0��0)��B![]() ��C
��C![]() ����Dԭ�ӵ��������Ϊ________��
����Dԭ�ӵ��������Ϊ________��
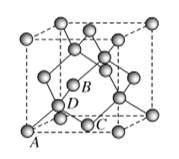
(6)������������Ľṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5 pm��������������ܶ���________ g��cm��3(�г�����ʽ���ɣ������ӵ�������ֵΪNA)��
���𰸡�4 ƽ�������� NO3-��SO3�� MgO�����ܱ�CaO��ʹ��Mg2+��Ca2+�������̼��������е������� O>N>C>H sp2 CO(NH2)2������ˮ����֮�����γ���� ![]() ��C
��C![]() O
O ![]()
![]()
��������
(1)̼ԭ�Ӻ�����6�����ӣ�����6�ֲ�ͬ�ռ��˶�״̬�ĵ��ӣ��ʴ�Ϊ��6��
(2)��CO![]() ������Cԭ�Ӽ۲���Ӷ���=3+
������Cԭ�Ӽ۲���Ӷ���=3+![]() =3��C��sp2�ӻ����µ��Ӷ���=
=3��C��sp2�ӻ����µ��Ӷ���=![]() =0�����ԣ�CO
=0�����ԣ�CO![]() �����幹����ƽ�������Ρ��۵�������ԭ������ͬ�ķ��ӡ����ӻ�ԭ���Ż�Ϊ�ȵ����壬CO
�����幹����ƽ�������Ρ��۵�������ԭ������ͬ�ķ��ӡ����ӻ�ԭ���Ż�Ϊ�ȵ����壬CO![]() �ļ۵�����=4+2+3��6=24���ɽ�C����N��S����NO3-��SO3��������CO
�ļ۵�����=4+2+3��6=24���ɽ�C����N��S����NO3-��SO3��������CO![]() ��Ϊ�ȵ��������NO3-��SO3�ȣ��ʴ�Ϊ��ƽ�������Σ�NO3-��SO3�ȣ�
��Ϊ�ȵ��������NO3-��SO3�ȣ��ʴ�Ϊ��ƽ�������Σ�NO3-��SO3�ȣ�
��MgO�����ܱ�CaO��ʹ��Mg2+��Ca2+�������̼��������е������ӣ����ԣ�MgCO3�ֽ��¶ȱ�CaCO3�ͣ��ʴ�Ϊ��MgO�����ܱ�CaO��ʹ��Mg2+��Ca2+�������̼��������е������ӣ�
(3)�ǽ�����Խǿ���縺��Խ�����Ե縺�ԣ�O>N>C>H��CO(NH2)2��Cԭ�ӵļ۲���Ӷ���=3+![]() =3������Cԭ�ӵ��ӻ���ʽΪsp2�ӻ���CO(NH2)2������ˮ����֮�����γ����������CO(NH2)2������ˮ���ʴ�Ϊ��O>N>C>H��sp2��CO(NH2)2������ˮ����֮�����γ������
=3������Cԭ�ӵ��ӻ���ʽΪsp2�ӻ���CO(NH2)2������ˮ����֮�����γ����������CO(NH2)2������ˮ���ʴ�Ϊ��O>N>C>H��sp2��CO(NH2)2������ˮ����֮�����γ������
(4)�ȵ�����������ƵĻ�ѧ��������CO��N2��Ϊ�ȵ����壬��CO�ĽṹʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��C
��C![]() O��
O��
(5)��ͼʾ��֪����D������4��ԭ���γ��������壬��Dλ��������������ģ���B��x�������Ϊ![]() ��֪��D��x�������Ϊ
��֪��D��x�������Ϊ![]() ��ͬ���ó�D��y��z��������Ϊ
��ͬ���ó�D��y��z��������Ϊ![]() ����Dԭ�ӵ��������Ϊ
����Dԭ�ӵ��������Ϊ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(6)��Ϊ���ʯ��������������������Cԭ�Ӵ����������8�����㣬6�����ģ�������4�����ʸ��ݾ�̯����BN�Ļ�ѧʽ��֪��һ�������и�����4��Bԭ�ӡ�4��Nԭ�ӣ�����Ϊһ��BN��������![]() ����һ�������������(361.5��1010)3cm3�����ܶ�=
����һ�������������(361.5��1010)3cm3�����ܶ�= ![]() g/cm3���ʴ�Ϊ��
g/cm3���ʴ�Ϊ��![]() ��
��

 Сѧ��ʱ��ҵȫͨ����ϵ�д�
Сѧ��ʱ��ҵȫͨ����ϵ�д� �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
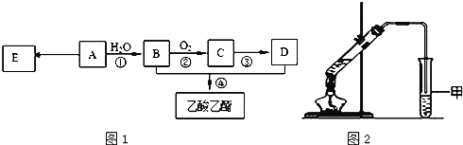
�»ƸԱ����ܾ�ϵ�д�����Ŀ����ϩ���Ǻϳɱ�ϩ��֬��ԭ�ϣ���ϩ�������������͡����ϵȡ�ijС���Ա�ϩȩΪԭ��������ϩ������ϩ���������ͼ��ʾ��
 ��֪��Ӧԭ����
��֪��Ӧԭ����![]()
![]()
�й����ʵ��������������
| ��ϩȩ | ��ϩ�� | ��ϩ�� | ���Ȼ�̼ |
�е�/�� | 53 | 97 | 141 | 77 |
�۵�/�� | -87 | -129 | 13 | -22.8 |
�ܶ�/gcm-3 | 0.84 | 0.85 | 1.02 | 1.58 |
�ܽ���(����) | ������ˮ�� �л��� | ����ˮ�� �л��ܼ� | ����ˮ�� �л��ܼ� | ������ˮ�� �������л��� |
��1����֪���ķе�Ϊ80.1�棬��������ڵ���ȡ�������Ȼ�̼�����ñ�������Ҫԭ�������_________________���ϲ�Һ���Һ©��________���������������������ڵ�����ţ�����
��2���Ӳ���ܵIJ���Һ�п���ȡһ����ˮ���Σ�����________���ѧʽ����
��3������ݲ�����ͼװ�ã���װ����һ�����Դ�����ָ������________������֮���ռ���ϩ�����¶�Ӧ������________���ҡ�

��4����֪��ȩ����н�ǿ��ԭ�ԣ�������ˮ�����Ը��������Һ��������Һ�ȷ�Ӧ��ijͬѧΪ��֤����ϩ���Ʒ�к��б�ϩȩ��������·�����
a.ȡ������ˮ���Թܣ�����������ϩ����Ʒ������Һ��ɫ
b.ȡ�������Ը��������Һ���Թܣ�����������ϩ����Ʒ������Һ��ɫ
c.ȡ����������Һ���Թܣ�����������ϩ����Ʒ����ˮԡ���ȣ�����������
d.ȡ���������ظ������Һ���Թܣ�����������ϩ����Ʒ������Һ�ɳȺ�ɫ�����ɫ
���������У���֤����ϩ���Ʒ�к�������ϩȩ����________������ĸ����
��6��Ϊ��֤����ϩ�������ᣬ������·����������ܴﵽʵ��Ŀ�ĵ���________������ĸ����
���� | ���� | Ԥ������ |
A | ȡ���� | ��Һ���ɫ |
B | �����£���10ml0.1molL-1NaOH��Һ��10ml0.1molL-1 | pH>7 |
C | ����ͬ�ĵ����Ƿֱ�ⶨ������Һ�� | ǰ�ߵ��ݽ��� |
����Ŀ����þ������þ��������ɰ����![]() ʱ�ķ���������Ҫ�ɷ���MgO��������
ʱ�ķ���������Ҫ�ɷ���MgO��������![]() ��CaO��
��CaO��![]() ��FeO��MnO��
��FeO��MnO��![]() �����ʡ�����þ��Ϊԭ����ȡ��ˮ����þ�Ĺ����������£�
�����ʡ�����þ��Ϊԭ����ȡ��ˮ����þ�Ĺ����������£�
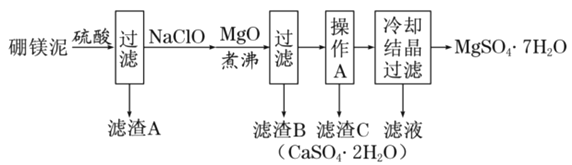
�ش��������⣺
(1)![]() ��B�Ļ��ϼ�Ϊ__________��
��B�Ļ��ϼ�Ϊ__________��
(2)![]() ������ˮ��Ҳ����ˮ�⣺
������ˮ��Ҳ����ˮ�⣺![]() ����
����![]() �����ڳ������ܽ�Ƚ�С
�����ڳ������ܽ�Ƚ�С![]() ��д����������ʱ
��д����������ʱ![]() ������Ӧ�Ļ�ѧ����ʽ��_____��
������Ӧ�Ļ�ѧ����ʽ��_____��
(3)����B�к��в�����ϡ���ᵫ��������Ũ����ĺ�ɫ���壬д�����ɺ�ɫ��������ӷ���ʽ____________��
(4)����MgO��Ŀ����___________________��
(5)��֪![]() ��
��![]() ���ܽ�����±���
���ܽ�����±���
�¶� | 40 | 50 | 60 | 70 |
|
|
|
|
|
|
|
|
|
|
������A���ǽ�![]() ��
��![]() �����Һ�е�
�����Һ�е�![]() ��ȥ�������ϱ����ݣ���Ҫ˵��������A������Ϊ____________________��
��ȥ�������ϱ����ݣ���Ҫ˵��������A������Ϊ____________________��
(6)��ɰҲ���ڹ�ҵ����ȡ![]() ��
��![]() ����Ϊ�л���ѧ�е������ܻ�ԭ������
����Ϊ�л���ѧ�е������ܻ�ԭ������
![]() �
д��![]() �ĵ���ʽ��___________��
�ĵ���ʽ��___________��
![]() ����Ч�⺬�����������������ԭ���Ļ�ԭ�������䶨���ǣ�ÿ�˺��ԭ���Ļ�ԭ�����൱�ڶ��ٿ�
����Ч�⺬�����������������ԭ���Ļ�ԭ�������䶨���ǣ�ÿ�˺��ԭ���Ļ�ԭ�����൱�ڶ��ٿ�![]() �Ļ�ԭ������
�Ļ�ԭ������![]() ����Ч�⺬��Ϊ_________
����Ч�⺬��Ϊ_________![]() ������λС��
������λС��![]() ��
��
![]() �ڼ��������£��������ϵ��
�ڼ��������£��������ϵ��![]() Ҳ���Ƶ����⻯�ƣ�д�������ҵĵ缫��Ӧʽ��________��
Ҳ���Ƶ����⻯�ƣ�д�������ҵĵ缫��Ӧʽ��________��