题目内容
1.在酸性或碱性较强的溶液中,铝均可以溶解,但在家庭里,用食盐腌制的食品亦不能长期存放在铝制品中,其主要原因是( )| A. | 铝能与NaCl直接发生反应而被氧化为氧化铝 | |
| B. | 长期存放的NaCl与水反应,溶液不再呈中性,可与铝发生反应 | |
| C. | 铝与其中的杂质、NaCl溶液形成原电池,铝被氧化 | |
| D. | 铝与其中的杂质、NaCl溶液形成原电池,铝被还原 |
分析 金属铝既能和酸之间反应又能和碱之间反应,在电解质溶液中易形成原电池反应,作原电池负极的金属易被腐蚀,据此分析解答.
解答 解:铝中含有其它杂质,铝和杂质、氯化钠溶液构成原电池,铝易失电子发生氧化反应而作负极,被氧化,加速被腐蚀,所以但在家庭里,用食盐腌制的食品亦不能长期存放在铝制品中,故选C.
点评 本题以原电池原理为载体考查铝的性质,明确原电池原理是解本题关键,知道正负极的判断方法,原电池中金属负极加速被腐蚀,正极被保护.

练习册系列答案
相关题目
11.下列离子方程式正确的是( )
| A. | 铁粉加入三氯化铁溶液中 Fe+Fe3+═2Fe2+ | |
| B. | Cl2与水的反应Cl2+H2O═2H++Cl-+ClO- | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
12. 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A. | 反应开始至2min,Z的反应速率为0.10mol•L-1•min-1 | |
| B. | 该反应的化学方程式为3X+Y?2Z | |
| C. | 2min时,反应达最大限度,但化学反应仍在进行 | |
| D. | 反应达到平衡时,压强是开始时的0.9倍 |
16.将ag镁铁合金投入适量稀硝酸(假设NO是唯一的还原产物,不考虑溶解氧等其它氧化剂)中,当硝酸消耗完时收集到标准状况下2.24L的气体.然后向反应后的溶液中加入3mol•L-1NaOH溶液至金属恰好沉淀完全,沉淀质量为bg,则下列说法不正确的( )
| A. | 若在与硝酸反应后的溶液中再加入Fe,金属可能溶解 | |
| B. | 消耗的氢氧化钠的体积为100mL | |
| C. | b=a+5.1 | |
| D. | a的范围为:3.6<a<5.6 |
6.某待测无色溶液中滴入酚酞试剂,结果溶液呈红色,由此可得出的结论是( )
| A. | 溶液中溶有NaOH | B. | 溶质可能是Cu2(OH)2CO3 | ||
| C. | 溶液中一定不含有H+离子 | D. | 溶液呈碱性 |
10.在某酸性溶液中,一定能大量共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | NH4+、K+、SO42-、Cl- | ||
| C. | Na+、Al3+、AlO2-、NO3- | D. | Fe2+、K+、S042-、NO3- |
5.下列说法不正确的是( )
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响.雾霾中PM2.5属于胶体 | |
| C. | 分光光度计可以用来测定某些化学反应的反应速率 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
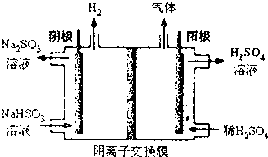 二甲醚(CH3OCH4)是一种重要的清洁燃料,工业上利用水煤气合成二甲醚的三步反应如下:
二甲醚(CH3OCH4)是一种重要的清洁燃料,工业上利用水煤气合成二甲醚的三步反应如下: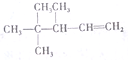 命名3,4,4-三甲基-1-戊烯
命名3,4,4-三甲基-1-戊烯