题目内容
11.下列离子方程式正确的是( )| A. | 铁粉加入三氯化铁溶液中 Fe+Fe3+═2Fe2+ | |
| B. | Cl2与水的反应Cl2+H2O═2H++Cl-+ClO- | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
分析 A.电子、电荷不守恒;
B.生成的HClO在离子反应中保留化学式;
C.电子、电荷不守恒;
D.反应生成醋酸钙、水、二氧化碳.
解答 解:A.铁粉加入三氯化铁溶液中的离子反应为Fe+2Fe3+═3Fe2+,故A错误;
B.Cl2与水的反应的离子反应为Cl2+H2O═H++Cl-+HClO,故B错误;
C.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+═Cu2++2Ag,故C错误;
D.大理石溶于醋酸的反应的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,综合性较强,题目难度不大.

练习册系列答案
相关题目
1.N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应:2N2O5(g)?4NO2(g)+O2(g)△H>0,反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法中不正确的是( )
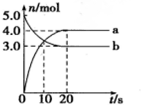

| A. | 曲线a表示NO2的物质的量随时间的变化 | |
| B. | 10s时,v(正)>v(逆) | |
| C. | 20s时反应达到平衡 | |
| D. | 0~20s内平均反应速率v(O2)=0.05mol•L-1•s-1 |
2.下列化学用语描述中不正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{37}Cl$ | |
| B. | K2O的电子式: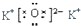 | |
| C. | HCO3-的电离方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 比例模型 可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
16.蒸干并灼烧下列物质的水溶液,仍能得到该物质的是( )
| A. | 氯化铝 | B. | 碳酸氢钠 | C. | 硫酸亚铁 | D. | 碳酸钠 |
3.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 2.4gMg溶于足量稀盐酸,转移的电子数为0.1NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 的数目为NA |
1.在酸性或碱性较强的溶液中,铝均可以溶解,但在家庭里,用食盐腌制的食品亦不能长期存放在铝制品中,其主要原因是( )
| A. | 铝能与NaCl直接发生反应而被氧化为氧化铝 | |
| B. | 长期存放的NaCl与水反应,溶液不再呈中性,可与铝发生反应 | |
| C. | 铝与其中的杂质、NaCl溶液形成原电池,铝被氧化 | |
| D. | 铝与其中的杂质、NaCl溶液形成原电池,铝被还原 |

 .
. .
. Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.