题目内容
10.在某酸性溶液中,一定能大量共存的离子组是( )| A. | Na+、K+、SO42-、HCO3- | B. | NH4+、K+、SO42-、Cl- | ||
| C. | Na+、Al3+、AlO2-、NO3- | D. | Fe2+、K+、S042-、NO3- |
分析 A.碳酸氢根离子与酸性溶液中的氢离子反应生成二氧化碳气体;
B.四种离子之间不反应,都不与酸性溶液中的氢离子反应;
C.铝离子、偏铝酸根离子之间发生双水解反应生成氢氧化铝沉淀;
D.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子.
解答 解:A.HCO3-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故A错误;
B.NH4+、K+、SO42-、Cl-之间不发生反应,都不与酸性溶液中的氢离子反应,在溶液中能够大量共存,故B正确;
C.Al3+、AlO2-之间发生水解反应生成氢氧化铝沉淀,在溶液中不能大量共存,故C错误;
D.NO3-、Fe2+之间在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生条件为解答关键,注意掌握常见的离子不能共存的情况,如发生复分解反应、发生氧化还原反应等,还要注意题干隐含条件的含义.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
1.在酸性或碱性较强的溶液中,铝均可以溶解,但在家庭里,用食盐腌制的食品亦不能长期存放在铝制品中,其主要原因是( )
| A. | 铝能与NaCl直接发生反应而被氧化为氧化铝 | |
| B. | 长期存放的NaCl与水反应,溶液不再呈中性,可与铝发生反应 | |
| C. | 铝与其中的杂质、NaCl溶液形成原电池,铝被氧化 | |
| D. | 铝与其中的杂质、NaCl溶液形成原电池,铝被还原 |
18.烃类分子中的碳原子与其它原子的结合方式是( )
| A. | 形成四对共用电子对 | B. | 通过非极性键 | ||
| C. | 通过两个共价键 | D. | 通过离子键和共价键 |
15.将等物质的量的X、Y气体充入固定容积的密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+Y(g)?2Z(g)△H<0.当改变某个条件建立新的平衡时,下表中关于新平衡与原平衡的比较正确的是 ( )
| 改变的条件 | 新平衡与原平衡比较 | |
| A | 向容器中充入He气 | X的转化率变大 |
| B | 增大压强 | X的浓度变大 |
| C | 充入一定量Y | Y的转化率增大 |
| D | 使用适当催化剂 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
2.若20g密度为ρ g•cm-3的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为( )
| A. | $\frac{ρ}{400}$mol•L-1 | B. | $\frac{20}{ρ}$mol•L-1 | C. | $\frac{50ρ}{41}$mol•L-1 | D. | $\frac{25ρ}{41}$mol•L-1 |
13.国际化学年的主题是“化学--我们的生活,我们的未来”.下列做法不正确的是( )
| A. | 利用露天焚烧方法处理塑料废弃物 | |
| B. | 利用高纯单质硅制成太阳能电池 | |
| C. | 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯塑料 |
14.NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下:关于NM-3和D-58的叙述,错误的是( )


| A. | 都能与NaOH溶液反应,每mol消耗NaOH的物质的量之比为1:1 | |
| B. | 都能与溴水反应,每mol消耗Br2的物质的量之比为3:2 | |
| C. | 都能与H2发生加成反应,每mol消耗H2的物质的量之比为4:7 | |
| D. | 都能与O2发生氧化反应,每mol消耗O2的物质的量之比为13:15 |
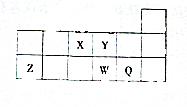 短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示
短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示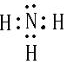 ,其水溶液呈碱性性(填酸、碱或中)
,其水溶液呈碱性性(填酸、碱或中)