题目内容
16.将ag镁铁合金投入适量稀硝酸(假设NO是唯一的还原产物,不考虑溶解氧等其它氧化剂)中,当硝酸消耗完时收集到标准状况下2.24L的气体.然后向反应后的溶液中加入3mol•L-1NaOH溶液至金属恰好沉淀完全,沉淀质量为bg,则下列说法不正确的( )| A. | 若在与硝酸反应后的溶液中再加入Fe,金属可能溶解 | |
| B. | 消耗的氢氧化钠的体积为100mL | |
| C. | b=a+5.1 | |
| D. | a的范围为:3.6<a<5.6 |
分析 标况下2.24LNO的物质的量为:n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,反应中转移电子的物质的量为:0.1mol×(5-2)=0.3mol,则合金中铁和镁失去电子的物质的量为0.3mol;金属离子所带电荷一定为0.3mol,则加入氢氧化钠后生成的氢氧化物沉淀中含有氢氧根离子的物质的量为0.3mol,需要消耗氢氧化钠溶液的体积为:$\frac{0.3mol}{3mol/L}$=0.1L=100mL;生成沉淀的质量=合金质量+氢氧根离子的质量,即:bg=ag+17g/mol×0.3mol=ag+5.1g;
当合金中完全为计算镁时,合金质量最小,根据电子守恒,镁的物质的量为:$\frac{0.3mol}{2}$=0.15mol,质量为:24g/mol×0.15mol=3.6g;当合金完全为铁,且生成的为亚铁离子时,合金质量最大,最大物质的量为:$\frac{0.3mol}{2}$=0.15mol,质量为:56g/mol×0.15mol=8.4g,则a的范围为:3.6<a<8.4g,据此对各选项进行判断.
解答 解:A.根据题中信息可知,硝酸和金属都完全反应,反应后溶质可能为:①硝酸镁和硝酸铁、②硝酸镁和硝酸亚铁、③硝酸镁硝酸亚铁、硝酸铁,若反应生成的是①或③,则反应后的溶液中再加入Fe,金属能够溶解,故A正确;
B.标况下2.24LNO的物质的量为:n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,反应中转移电子的物质的量为:0.1mol×(5-2)=0.3mol,则合金中铁和镁失去电子的物质的量为0.3mol;金属离子所带电荷一定为0.3mol,则加入氢氧化钠后生成的氢氧化物沉淀中含有氢氧根离子的物质的量为0.3mol,需要消耗氢氧化钠溶液的体积为:$\frac{0.3mol}{3mol/L}$=0.1L=100mL,故B正确;
C.生成沉淀的质量=合金质量+氢氧根离子的质量,即:bg=ag+17g/mol×0.3mol=ag+5.1g,故C正确;
D.当合金中完全为金属镁时,合金质量最小,根据电子守恒可知镁的物质的量为:$\frac{0.3mol}{2}$=0.15mol,质量为:24g/mol×0.15mol=3.6g;当合金完全为铁,且生成的为亚铁离子时,合金质量最大,最大物质的量为:$\frac{0.3mol}{2}$=0.15mol,质量为:56g/mol×0.15mol=8.4g,则a的范围为:3.6<a<8.4g,故D错误;
故选D.
点评 本题考查了混合物反应的计算,题目难度较大,明确反应发生实质为解答关键,本题中需要分析、总结出沉淀中氢氧根离子的物质的量与转移电子的物质的量相等,试题侧重考查学生的分析能力及化学计算能力.

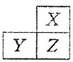 X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | 原子半径:X>Y>Z | |
| B. | 气态氢化物的热稳定性:X<Z | |
| C. | Y和Z的最高价氧化物对应水化物均为强酸 | |
| D. | X和Z形成的化合物只有共价键 |
| A. | 3.4gNH3中含有电子数为2NA | |
| B. | 0.1mol/L CuSO4溶液中含有的SO2-4数目为0.1NA | |
| C. | 常温常压下,2.24L O3中含有的氧原子数为0.3NA | |
| D. | 8.7gMnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的氯分子数为0.1NA |
| A. | SO32-的空间构型为平面三角形 | |
| B. | SiO2晶体中,最小的环上有6个Si原子和6个O原子 | |
| C. | CuSO4•5H2O中Cu的配位数为4 | |
| D. | SnBr2分子中Sn-Br的键角为120° |
| A. | 铝能与NaCl直接发生反应而被氧化为氧化铝 | |
| B. | 长期存放的NaCl与水反应,溶液不再呈中性,可与铝发生反应 | |
| C. | 铝与其中的杂质、NaCl溶液形成原电池,铝被氧化 | |
| D. | 铝与其中的杂质、NaCl溶液形成原电池,铝被还原 |
 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.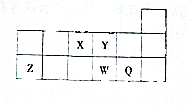 短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示
短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示 ,其水溶液呈碱性性(填酸、碱或中)
,其水溶液呈碱性性(填酸、碱或中) 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).