题目内容
氯化铍是用于制有机铍化合物和金属铍的重要原料.
(1)Be原子的基态价电子排布式为 ,其元素的第一电离能 B元素(填“>”或“<”或“=”),原因是 .
(2)BeCl2中Be原子的杂化轨道类型是 .
(3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子最外层达到8电子稳定结构,阴离子的结构式为 .
(1)Be原子的基态价电子排布式为
(2)BeCl2中Be原子的杂化轨道类型是
(3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子最外层达到8电子稳定结构,阴离子的结构式为
考点:原子核外电子排布,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)根据核外电子排布规律书写Be原子的基态价电子排布式;Be的2s轨道为全充满稳定状态,稳定状态,体系能量低;
(2)BeCl2中Be原子的杂化轨道数为2;
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构.
(2)BeCl2中Be原子的杂化轨道数为2;
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构.
解答:
解:(1)Be原子的电子排布式为1s22s2,Be原子的基态价电子排布式为2s2.Be的2s轨道为全充满,稳定状态,体系能量低,第一电离能高于同周期相邻元素,
故答案为:2s2;>;Be的2s轨道全充满,体系能量低;
(2)BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取 sp 杂化方式,
故答案为:sp杂化;
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,结构式为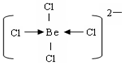 ,
,
故答案为: .
.
故答案为:2s2;>;Be的2s轨道全充满,体系能量低;
(2)BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取 sp 杂化方式,
故答案为:sp杂化;
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,结构式为
 ,
,故答案为:
 .
.
点评:本题考查核外电子排布规律、电离能、杂化轨道、化学键等,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
下列关于钠、镁、铝性质说法正确的是( )
| A、铝的金属性最强 |
| B、镁的原子半径最大 |
| C、它们的最高价氧化物的水化物中,只有NaOH属于强碱 |
| D、铝的最高价是+3价,最低价是-5价 |
下列电子式的书写正确的是( )
A、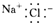 |
B、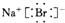 |
C、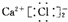 |
D、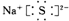 |
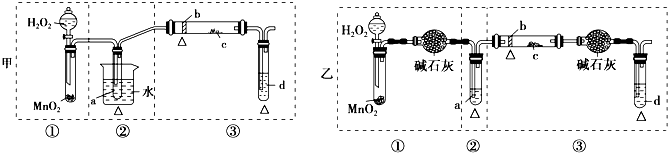
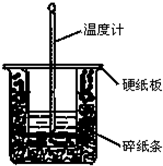 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: