题目内容
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl (g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
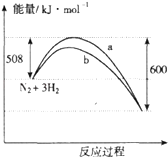
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 . 请回答下列问题: 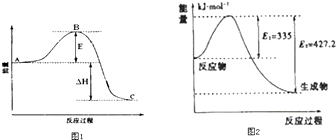
①图中△H=KJmol﹣1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,
(4)①如图2是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2 , 达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为;若在同体积的容器中充入2mol N2和6mol H2 , 达平衡后放出的热量为Q2 kJ,则Q22Q1(填“>”、“<”或“=”)
【答案】
(1)CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣704KJ/mol
O2(g)═CO2(g)+2H2O(l)△H=﹣704KJ/mol
(2)432kJ/mol
(3)﹣198;降低
(4)46.1kJ;18.44;>
【解析】解:(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O (l)△H=﹣704KJ/mol;所以答案是:CH3OH(l)+
O2(g)═CO2(g)+2H2O (l)△H=﹣704KJ/mol;所以答案是:CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O (l)△H=﹣704KJ/mol;(2)H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
O2(g)═CO2(g)+2H2O (l)△H=﹣704KJ/mol;(2)H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
△H=反应物键能总和﹣生成物键能总和得到:﹣185kJ/mol=436KJ/mol+243KJ/mol﹣2E(H﹣Cl)
则E(H﹣Cl)=432kJ/mol;
所以答案是:432kJ/mol;(3)①因1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 , 所以2molSO2(g)氧化为2molSO3的△H=﹣198kJmol﹣1 ,
则2SO2(g)+O2(g)=2SO3(g)△H=﹣198KJmol﹣1 , 所以答案是:﹣198;
②因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,加入催化剂,活化能减小,
所以答案是:降低;(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,所以生成1mol氨气放热46.1KJ;
所以答案是:46.1 kJ;
②如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,
N2(g)+ | 3H2(g) | = | 2NH3(g) | △H=﹣92.2KJ/mol |
1 | 3 | 0 | ||
0.2 | 0.6 | 0.4 |
生成0.4mol氨气放热= ![]() ×92,2KJ=18.44KJ;
×92,2KJ=18.44KJ;
若在同体积的容器中充入2mol N2和6mol H2 , 可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行达平衡后放出的热量Q2 大于2Q1;
所以答案是:18.44,>.