题目内容
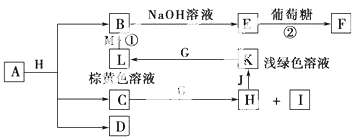
【题目】A是化合物,B是金属单质,它们之间相互反应以及生成物之间的转化关系如图所示: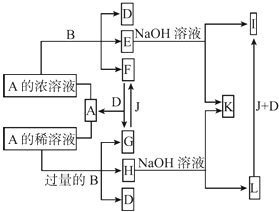
(1)金属B在元素周期表中的位置是 , B和A的浓溶液反应的条件是 . 写出少量B与A的稀溶液反应的离子方程式: .
(2)常温下0.1 mol/L E的水溶液中各离子浓度大小关系为 .
(3)L转化为I的现象是 . 写出有关的化学方程式: .
(4)如何检测H溶液中阳离子的存在,写出实验操作方法、现象、结论: .
(5)已知25℃时Fe(OH)3的Ksp=3.5×10﹣39 , 现将4.0×10﹣8 mol/L E溶液与2.0×10﹣8 mol/L NaOH溶液等体积混合(忽略溶液混合时体积的变化),通过列式计算说明是否有沉淀产生: .
【答案】
(1)第四周期Ⅷ族;加热;Fe+4H++NO3﹣=Fe2++NO↑+2H2O
(2)c(NO ![]() )>c(Fe3+)>c(OH﹣)>c(H+)
)>c(Fe3+)>c(OH﹣)>c(H+)
(3)白色沉淀变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+
(5)混合后溶液中的c(Fe3+)=2×10﹣8mol/L,c(OH﹣)=1×10﹣8mol/L,则Qc=c(Fe3+)×c3(OH﹣)=2.0×10﹣32>Ksp , 有沉淀生成
【解析】解:E、H与氢氧化钠溶液反应分别生成I、L,I和L又能和J、D发生转化,说明金属B为变价金属,B可能为Fe.E、H均为B盐溶液,A能与B反应生成多种物质,说明A为酸,A与Fe反应时与酸的浓度有关,则A可能是硫酸或硝酸,根据G+J→F可以判断A是硝酸不是硫酸(氢气与二氧化硫无法转化),故酸A为HNO3 , B为Fe,结合转化关系,可推知F为NO2 , A为HNO3 , E为Fe(NO3)3、D为H2O、I为Fe(OH)3、G为NO、F为O2、H为Fe(NO3)2 , L为Fe(OH)2 , K为NaNO3 . (1)金属B为Fe,在元素周期表中的位置是:第四周期Ⅷ族,Fe和浓硝酸反应的条件是:加热,少量Fe与稀硝酸反应的离子方程式:Fe+4H++NO3﹣=Fe2++NO↑+2H2O,所以答案是:第四周期Ⅷ族;加热;Fe+4H++NO3﹣=Fe2++NO↑+2H2O;(2)常温下0.1 mol/L Fe(NO3)3的水溶液中Fe3+水解,溶液呈酸性,各离子浓度大小关系为:,
所以答案是:c(NO3﹣)>c(Fe3+)>c(OH﹣)>c(H+),
所以答案是:c(NO3﹣)>c(Fe3+)>c(OH﹣)>c(H+);(3)L转化成I的现象是:白色沉淀变成灰绿色,最终变成红褐色,有关的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
所以答案是:白色沉淀变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)检测Fe(NO3)2溶液中阳离子的存在:取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+ ,
所以答案是:取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+;(5)等体积混合的瞬间,体积加倍浓度减半,混合后溶液中的c(Fe3+)=2×10﹣8mol/L,c(OH﹣)=1×10﹣8mol/L,则Qc=c(Fe3+)×c3(OH﹣)=2.0×10﹣32>Ksp , 有沉淀生成,
所以答案是:混合后溶液中的c(Fe3+)=2×10﹣8mol/L,c(OH﹣)=1×10﹣8mol/L,则Qc=c(Fe3+)×c3(OH﹣)=2.0×10﹣32>Ksp , 有沉淀生成.