题目内容
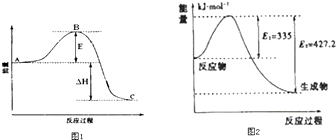
【题目】如图是373K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( ) 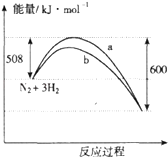
A.该反应的热化学方程式为:N2+3H22NH3△H=﹣92kJmol﹣1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2=2Q1
【答案】C
【解析】解:A、热化学方程式必须标注物质的聚集状态反应的焓变,该反应的热化学方程式为:N2(g)+3H2(g)2NH3(g),△H=﹣92kJmol﹣1 , 故A错误;B、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故图象中的b曲线是加入正催化剂时的能量变化曲线,故B错误;
C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,所以该化学反应的反应热不变,故C正确;
D、在相同温度的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ,如果平衡不移动,则Q2=2Q1 , 但是增大反应物物质的量器压强增大,平衡正移,所以放出的热量增多,Q2>2Q1 , 故D错误;
故选:C.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

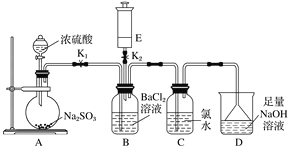
【题目】如图,把气体缓慢通入盛有足量试剂的试剂瓶A和试管B,在试管B中不能观察到明显现象的是( )
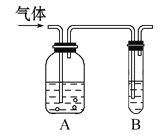
选项 | 气体 | A中试剂 | B中试剂 |
A | SO2、CO2 | 酸性KMnO4溶液 | 澄清石灰水 |
B | Cl2、HCl | 饱和NaCl溶液 | KI淀粉溶液 |
C | CO2、HCl | 饱和NaHCO3溶液 | NaAlO2溶液 |
D | NH3、CO2 | 浓硫酸 | 酚酞试液 |
A. A B. B C. C D. D