��Ŀ����
����Ŀ����ҵ���ó�����Fe2O3��FeO��Ҳ����Al2O3��MnO2��CuO��SiO2�ȣ��Ʊ��̷�FeSO4��7H2O���������£�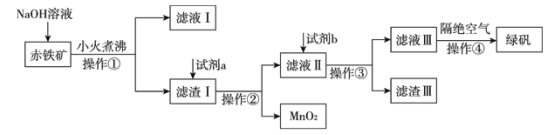
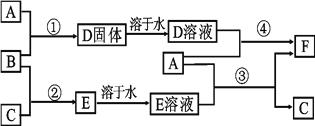
��1������������Һ����������з�����Ӧ�����ӷ���ʽΪ___________________________��
________________________________��
��2�����������м���������Լ�aΪ___________���������Լ�bͶ�뵽��Һ���������з�Ӧ�����ӷ���ʽΪ__________________________��________________________________��
___________________________________��
��3��ʵ�����в����٢ڢ۵�����Ϊ_________________________��
��4�������ܸ���������Ŀ����_______________________________________________��
���𰸡� Al2O3 +2OH-=2AlO2��+H2O SiO2+ 2OH-=SiO32-+ H2O ����(H2SO4) Fe��2Fe3+��3Fe2+ Fe��Cu2+��Cu��Fe2+ Fe��2H+��H2����Fe2+ ���� ��ֹ��Һ�е�Fe2+����������ΪFe3+
����������������������̿�֪����������������������Һ��ȡʱ���������Ͷ��������ܽ⣬���ˣ�������I�м���������ϡ���ᣬ���е������������������Լ�����ͭ�ܽ⣬���ˣ�����Һ�м������ۣ�����Һ�е�Fe3+��Cu2+��ԭ�����˵õ�����������Һ������Һ����Ũ�������½ᾧ�����ˡ�ϴ�ӡ�����õ��̷���
��1������������Һ����������з�����Ӧ�����ӷ���ʽΪAl2O3 +2OH-=2AlO2��+H2O��
SiO2+ 2OH-=SiO32-+ H2O��
��2�����������м���������Լ�aΪ����(H2SO4)���������Լ�b�����ۣ�Ͷ�뵽��Һ���������з�Ӧ�����ӷ���ʽΪFe��2Fe3+��3Fe2+��Fe��Cu2+��Cu��Fe2+��Fe��2H+��H2����Fe2+��
��3��ʵ�����в����٢ڢ۵�����Ϊ���ˡ�
��4�������ܸ���������Ŀ���Ƿ�ֹ��Һ�е�Fe2+����������ΪFe3+��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ͼ�������建��ͨ��ʢ�������Լ����Լ�ƿA���Թ�B�����Թ�B�в��ܹ۲쵽�����������(����)
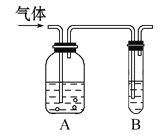
ѡ�� | ���� | A���Լ� | B���Լ� |
A | SO2��CO2 | ����KMnO4��Һ | ����ʯ��ˮ |
B | Cl2��HCl | ����NaCl��Һ | KI������Һ |
C | CO2��HCl | ����NaHCO3��Һ | NaAlO2��Һ |
D | NH3��CO2 | Ũ���� | ��̪��Һ |
A. A B. B C. C D. D