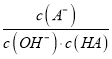题目内容
【题目】某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为____________________________。
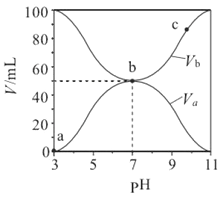
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
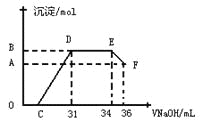
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为:___________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为_________。
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为________________________。
【答案】NaOH 2Al+2OH-+2H2O=2AlO2-+3H2↑ H+OH-=H2O NH4++OH-=NH3+H2O 2:1
【解析】
I.金属铝能和强碱溶液反应生成氢气而铁不能,可以用NaOH溶液检验铝的存在。
Ⅱ.铁、铝和硝酸反应无气体放出,猜测硝酸的还原产物有可能是铵根离子。发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。在反应结束后的溶液中,逐滴加入氢氧化钠溶液,根据图像可知,溶解金属的硝酸是过量的,开始阶段发生的是酸碱中和反应,从C点开始有沉淀生成,到D点沉淀达到最多,再加NaOH溶液,沉淀不再变化,说明此时发生的是铵根离子和OH-反应生成NH3·H2O,再加NaOH溶液,Al(OH)3会溶解。
I.铝能溶于氢氧化钠溶液中,而铁不能,据此可以鉴别,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
II(1)图中OC段没有沉淀生成,说明硝酸过量,所以反应的方程式是H++OH-=H2O。
(2)由于溶液中的金属阳离子首先和氢氧化钠反应,当沉淀达到最大值时,氢氧化再和溶液中的NH4+反应,所以DE段反应的方程式是NH4+ +OH-=NH3·H2O。
(3)氢氧化铝是两性氢氧化物,能溶于氢氧化钠中,所以EF段是溶解氢氧化铝的,方程式是Al(OH)3+OH-=AlO2-+2H2O,因此故图像可知,消耗氢氧化钠是2ml,物质的量是0.008mol,则氢氧化铝就是0.008mol。因此生成氢氧化铝消耗的氢氧化钠是0.024mol,所以和铁离子反应的氢氧化钠是0.018L×4mol/L-0.024mol=0.048mol,所以铁离子的物质的量是0.016mol,因此原溶液中Fe3+与Al3+的物质的量之比为2︰1。

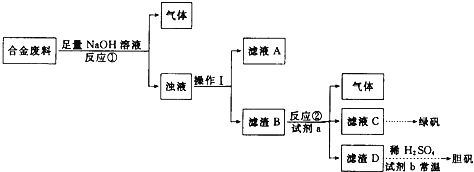
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:

(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。

①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______