题目内容
【题目】25℃时将浓度均为0.1mol·L-1、体积分别为Va和Vb的HA 溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示,下列说法正确的是
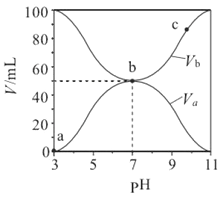
A. a→c 过程中水的电离程度始终增大
B. b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C. c点时, 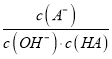 随温度升高而减小
随温度升高而减小
D. 相同温度下,Ka(HA)>Kb(BOH)
【答案】C
【解析】A. b点中和反应恰好完全进行,a→b剩余酸越来越少,溶液酸性逐渐减弱,水的电离程度增大,b→c剩余碱越来越多,溶液碱性逐渐增强,水的电离程度减小,故A错误;B. 溶液中电荷守恒:c(B+)+c(H+)=c(OH-)+c(A-),b点时,pH=7,溶液呈中性,c(H+)=c(OH-),所以c(B+)=c(A-),溶液中c(H+)和c(OH-)很小,所以c(B+)=c(A+)>c(H+)=c(OH-),故B错误;C. 0.1mol·L-1HA溶液pH=3,说明HA是弱酸,c点时溶质为BA、BOH,水解常数Kb= 随温度升高而增大,所以
随温度升高而增大,所以 随温度升高而减小,故C正确;D. Va=Vb=50mL时HA与BOH恰好完全反应,pH=7,所以相同温度下,Ka(HA)=Kb(BOH),故D错误。故选C。
随温度升高而减小,故C正确;D. Va=Vb=50mL时HA与BOH恰好完全反应,pH=7,所以相同温度下,Ka(HA)=Kb(BOH),故D错误。故选C。

练习册系列答案
相关题目