��Ŀ����
����Ŀ������п���㷺Ӧ����ҽҩ�����ũҵ��������ҵ��������п����Ҫ�ɷ�ΪZnO������ZnSiO3��FeCO3��CuO�ȣ�����ZnSO47H2O��һ��������ͼ��

��1���������IJ�����____________��
��2������������ϡ����������ʱ���費��ͨ�����ˮ������Ŀ����______________��
��3���������У���pHԼΪ5.1����Һ�м��������أ�����Fe(OH)3��MnO(OH)2���ֳ������÷�Ӧ�����ӷ���ʽΪ____________________________________________��
��4���������У�����п�۵�������______________��
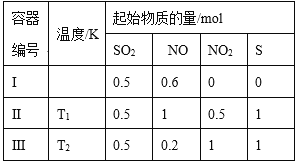
��5����֪����п���ܽ�����¶�֮��Ĺ�ϵ���±���
�¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 |
�ܽ��/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
������п��Һ�л������п�����ʵ�����Ϊ________________����ȴ�ᾧ�����ˡ���ɲ������ڼ�ѹ���������½��У�ԭ����_________________________________��
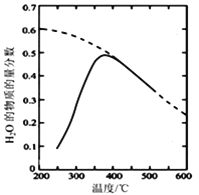
��6��ȡ28.70 g ZnSO47H2O��������ͬ�¶ȣ�ʣ�����������仯��ͼ��ʾ���������ݣ�680��ʱ���ù���Ļ�ѧʽΪ______��

a��ZnO b��Zn3O(SO4)2 c��ZnSO4 d��ZnSO4H2O
���𰸡� ���� �����¶ȡ�ʹ��Ӧ���ֻ�ϣ��Լӿ췴Ӧ���� 3Fe2++MnO4-+8H2O=3Fe(OH)3��+MnO(OH)2��+5H+ ��ȥCu2+ 60������������Ũ�� ���ͺ�ɵ��¶ȣ���ֹZnSO47H2O�ֽ� b
������������п��(��Ҫ�ɷ�ΪZnO,����ZnSiO3��FeCO3��CuO��)��ϡ�����ܽ�������,��Һ�к�������п������ͭ����������,�ټӸ��������Һ���������ӷ�Ӧ����MnO(OH)2������������������������Һ�к�������ͭ������п����п���û�ͭ����������������ΪCu���ܺ���Zn����ҺΪ����п�������������Ũ������ȴ�ᾧ�����˵õ�ZnSO47H2O
���������ݷ����ɻش�����������
(1)��������Һ��ͨ���ù��˵ķ�����ZnSiO3����ϡ���ᷴӦ���ɹ������ˮ��������õIJ���Ϊ��������Ϊ:����
(2) ����п���ڼ���ϡ�����ܽ��ͬʱ����ͨ�����ˮ���������������¶ȡ�ʹ��Ӧ���ֻ�ϣ��Ӷ��ӿ췴Ӧ��������Ϊ�������¶ȡ�ʹ��Ӧ���ֻ�ϣ��Լӿ췴Ӧ����
(3)��pHԼΪ5.1����Һ�м���������,���������Fe2+����������ԭ��Ӧ,����Fe(OH)3��MnO(OH)2���ֳ�������Ӧ�����ӷ���ʽΪ: 3Fe2++MnO4-+8H2O=3Fe(OH)3��+MnO(OH)2��+5H+����Ϊ��3Fe2++MnO4-+8H2O=3Fe(OH)3��+MnO(OH)2��+5H+
(4)�������У�����Һ�м���п��,������Cu2+��Ӧ�û���ͭ���Ӷ���ȥCu2+����Ϊ����ȥCu2+
(5)����Һ�л�þ���ͨ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ���ɵȲ���,��ΪZnSO47H2O�ֽ�,���Ժ�ɲ������ڼ�ѹ���������½���,��ˣ�������ȷ����:60![]() ����������Ũ�������ͺ�ɵ��¶�,��ֹZnSO47H2O�ֽ⡣��Ϊ��60������������Ũ�������ͺ�ɵ��¶ȣ���ֹZnSO47H2O�ֽ�
����������Ũ�������ͺ�ɵ��¶�,��ֹZnSO47H2O�ֽ⡣��Ϊ��60������������Ũ�������ͺ�ɵ��¶ȣ���ֹZnSO47H2O�ֽ�
(6)28.70gZnSO47H2O�����ʵ���Ϊ0.1mol,��ZnԪ���غ����֪��,����ZnSO4H2O��ZnSO4��ZnO��Zn3O(SO4)2ʱ,���ʵ�����Ϊ0.1mol,����ZnSO4H2O������Ϊ17.90g(100��);����ZnSO4������Ϊ16.10g(250��);����ZnO������Ϊ8.10g(930��);�ݴ�ͨ���ų���ȷ��680��ʱ���ù���Ļ�ѧʽΪZn3O(SO4)2����Ϊ��b