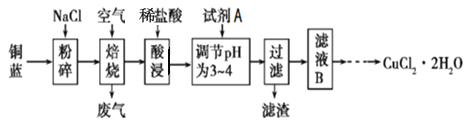
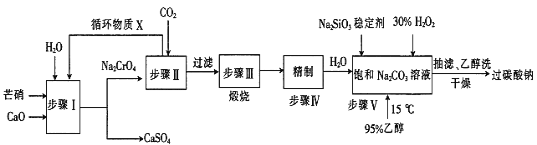
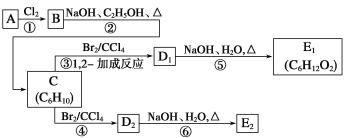
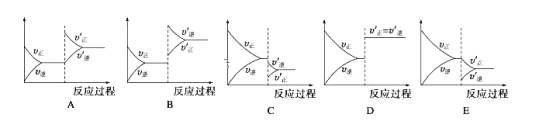
【题目】汽车尾气的主要成分有CO、SO2、氮氧化物等,科学家们-直致力于污染物的有效消除。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
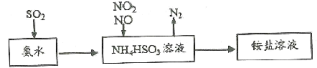
请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_________________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①己知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ· mol-1
2SO2(g)+O2(g)=2SO3(l) △H2=-288.4kJ· mol-1
N2(g)+O2(g)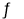 2NO(g) △H3=+180.5kJ· mol-1
2NO(g) △H3=+180.5kJ· mol-1
请判断反应NO2(g)+SO2(g)=NO(g)+SO3(l) △H4,在低温下能否自发进行_______(填“能”或“否”),理由是__________________________。
②己知TiO2催化尾气降解原理为:
2CO(g)+O2(g)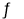 2CO2(g);2H2O(g)+4NO(g)+3O2(g)
2CO2(g);2H2O(g)+4NO(g)+3O2(g)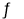 4HNO3(g)
4HNO3(g)
i、在一定条件下,模拟CO、NO的降解,得到降解率(即转化率)随时间变化如图所示,
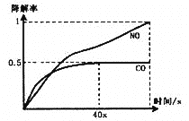
反应40秒后检测到混合气体中N2浓度上升,HNO3气体浓度有所降低,请用化学方程式并结合化学反应原理知识解释可能的原因____________________________________________。
ii,沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合图表回答下列问题:
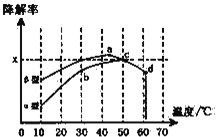
已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________(用含x的代数式表示);以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10~60℃范围内进行实验,请在图中用线段与阴影,仿照“示例”描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(示例: )_____________________。
)_____________________。
(3)利用如图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2,b极的电极反应式为_______________________________。

![]() ,而生成的硝酸的物质的量则是NO2的
,而生成的硝酸的物质的量则是NO2的![]() ;所以二者的浓度相同,如果气体摩尔体积为Vm,则烧瓶内溶质的物质的量浓度为
;所以二者的浓度相同,如果气体摩尔体积为Vm,则烧瓶内溶质的物质的量浓度为![]() ;
; ;所以经充分反应后烧瓶内溶质的物质的量浓度之比为
;所以经充分反应后烧瓶内溶质的物质的量浓度之比为![]() :
:![]() :
:![]() =5:5:4,故答案选C。
=5:5:4,故答案选C。