题目内容
【题目】在容积可变的密闭容器中充入2mol苯蒸气和4mol氢气,恒温T1和恒压P1条件下进行如下反应:![]() △H1= -208.8kJ· mol-1,达平衡时容器的体积为2L,苯的转化率为50%。下列有关说法正确的是( )
△H1= -208.8kJ· mol-1,达平衡时容器的体积为2L,苯的转化率为50%。下列有关说法正确的是( )
A.苯蒸气的体积分数不再变化时,说明该反应己达平衡状态
B.反应体系中气体总浓度保持不变,说明该反应己达平衡状态
C.在原平衡基础上,再向容器中充入3mol苯蒸气,平衡逆向移动
D.在原平衡基础上,升高温度,苯的转化率增大
【答案】C
【解析】
苯蒸汽原本有2mol,转化率为50%,则其转化量为1mol,故该反应的三段式为:
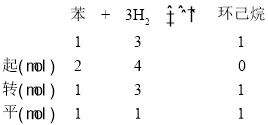 ,据此分析各个选项。
,据此分析各个选项。
A、根据PV=nRT可知,恒温恒压下,体系的总体积和体系的总物质的量呈正比,即苯蒸气的体积分数等于其物质的量分数;经分析,苯蒸汽在反应前和平衡时的物质的量分数都是![]() ,即从开始到平衡时,苯蒸汽的体积分数没有变化,所以苯蒸气的体积分数不再变化时,不能说明该反应己达平衡状态,A错误;
,即从开始到平衡时,苯蒸汽的体积分数没有变化,所以苯蒸气的体积分数不再变化时,不能说明该反应己达平衡状态,A错误;
B、根据PV=nRT可知,气体总浓度c=![]() ,则c恒定,故反应体系中气体总浓度保持不变,不能说明该反应己达平衡状态,B错误;
,则c恒定,故反应体系中气体总浓度保持不变,不能说明该反应己达平衡状态,B错误;
C、平衡时,c(苯)=c(H2)=c(环己烷) =![]() =0.5mol/L,则K=
=0.5mol/L,则K=![]() =8;平衡时,气体的总物质的量为3mol,体积为2L,再加入3mol苯蒸汽,气体的总体积变为4L,此时c(苯)=
=8;平衡时,气体的总物质的量为3mol,体积为2L,再加入3mol苯蒸汽,气体的总体积变为4L,此时c(苯)=![]() = 0.5mol/L,c(H2)=c(环己烷)=
= 0.5mol/L,c(H2)=c(环己烷)=![]() =0.25mol/L,则Qc=
=0.25mol/L,则Qc=![]() =16,即K<Qc,故平衡逆向移动,C正确;
=16,即K<Qc,故平衡逆向移动,C正确;
D、反应是放热反应,升高温度,平衡向逆反应方向移动,则苯的转化率减小,D错误;
故选C。

练习册系列答案
相关题目