题目内容
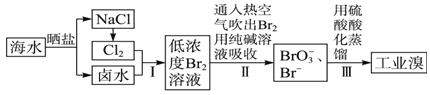
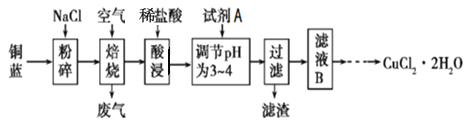
【题目】铜蓝是一种天然含铜矿石,它的主要成分是CuS,同时还含有少量铁的化合物。工业上常以铜蓝为原料生产可用作颜料、木材防腐剂等的化工产品![]() ,其工艺流程如下:
,其工艺流程如下:
已知:![]() 、
、![]() 、
、![]() 完全沉淀时的pH分别为
完全沉淀时的pH分别为![]() 、
、![]() 、
、![]() 。
。
![]() 与
与![]() 的溶解度曲线如图所示。
的溶解度曲线如图所示。

![]() “焙烧”时,主反应的产物为等物质的量的两种盐。写出相应的化学反应方程式 _________________________。
“焙烧”时,主反应的产物为等物质的量的两种盐。写出相应的化学反应方程式 _________________________。
![]() 结合题意,试剂A最好选用______
结合题意,试剂A最好选用______![]() 填编号
填编号![]()
![]()
![]()
![]()
![]() 浓硫酸
浓硫酸
选择该试剂的理由是____________________________。所得滤渣为________________。
![]() 为了获得
为了获得![]() 晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线
晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线![]() 图
图![]() ,“趁热过滤”得到的固体是_____________,“冷却结晶”过程中,析出
,“趁热过滤”得到的固体是_____________,“冷却结晶”过程中,析出![]() 晶体的合适温度为___________________。
晶体的合适温度为___________________。
![]() 色光度是产品质量指标之一,合格
色光度是产品质量指标之一,合格![]() 晶体的色光度范围为
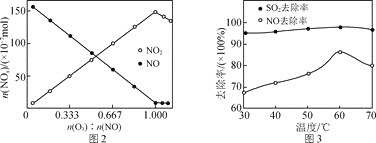
晶体的色光度范围为![]() ,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是_______________。
,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是_______________。
![]() 已知铜蓝的形成过程如下:
已知铜蓝的形成过程如下:![]() 在自然界中,各种原生铜的矿物经氧化转变为可溶性的
在自然界中,各种原生铜的矿物经氧化转变为可溶性的![]() 溶液,
溶液,![]() 经淋滤作用后溶液向地壳深部渗透,遇到深层的闪锌矿
经淋滤作用后溶液向地壳深部渗透,遇到深层的闪锌矿![]() 或方铅矿
或方铅矿![]() 慢慢转化为铜蓝
慢慢转化为铜蓝![]() 。写出过程
。写出过程![]() 中任意一个反应的离子方程式 ________________。
中任意一个反应的离子方程式 ________________。
【答案】CuS+2NaCl+2O2![]() CuCl2+Na2SO4
CuCl2+Na2SO4 ![]() NaClO溶液显碱性,在氧化残留的
NaClO溶液显碱性,在氧化残留的![]() 的同时能增大溶液的pH值,保证使
的同时能增大溶液的pH值,保证使![]() 沉淀而除去
沉淀而除去 ![]()
![]()
![]()
![]()
![]() 或
或![]()
【解析】
流程分析废渣粉碎加入氯化钠,通入空气焙烧后加入盐酸酸浸,加入试剂A是氧化剂将亚铁离子氧化为铁离子,调节溶液PH使铁离子沉淀;过滤后的滤液中主要是氯化铜溶液蒸发浓缩,冷却结晶得到氯化铜晶体。
![]() 焙烧”时,主反应是硫化铜和氧气在氯化钠的环境中发生氧化还原反应生成等物质的量的两种盐氯化铜和硫酸钠,所以相应的化学反应方程式为:CuS+2NaCl+2O2
焙烧”时,主反应是硫化铜和氧气在氯化钠的环境中发生氧化还原反应生成等物质的量的两种盐氯化铜和硫酸钠,所以相应的化学反应方程式为:CuS+2NaCl+2O2![]() CuCl2+Na2SO4;
CuCl2+Na2SO4;
![]() 结合题意,试剂A是为了氧化二价铁离子,使其转化成三价铁离子达到除杂的目的,又因为不能引入新的杂质,所以最好选用
结合题意,试剂A是为了氧化二价铁离子,使其转化成三价铁离子达到除杂的目的,又因为不能引入新的杂质,所以最好选用![]() ;NaClO溶液显碱性,在氧化残留的
;NaClO溶液显碱性,在氧化残留的![]() 的同时能增大溶液的pH值,保证使
的同时能增大溶液的pH值,保证使![]() 沉淀成氢氧化铁而除去;所得滤渣为
沉淀成氢氧化铁而除去;所得滤渣为![]() ;
;
![]() 为了获得
为了获得![]() 晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品,分析有关物质的溶解度曲线
晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品,分析有关物质的溶解度曲线![]() 图
图![]() ,温度高时,氯化铜的溶解度大于硫酸钠的,所以“趁热过滤”得到的固体应是
,温度高时,氯化铜的溶解度大于硫酸钠的,所以“趁热过滤”得到的固体应是![]() ;“冷却结晶”过程中,根据溶解度曲线,析出
;“冷却结晶”过程中,根据溶解度曲线,析出![]() 晶体而又不析出杂质的最佳温度应是
晶体而又不析出杂质的最佳温度应是![]() ;
;
![]() 根据图2综合分析,合格
根据图2综合分析,合格![]() 晶体的色光度范围为
晶体的色光度范围为![]() ,满足此要求又要保证产率高的pH应控制在
,满足此要求又要保证产率高的pH应控制在![]() ;
;
![]() 过程中涉及沉淀的转化,反应的离子方程式可表示为
过程中涉及沉淀的转化,反应的离子方程式可表示为![]() 或
或![]() 。
。