题目内容
11.同一周期相邻的A、B、C三种元素,都是短周期元素,A的最高价氧化物的化学式是A2O,11.6gB的氢氧化物恰好能与200mL2mol/L盐酸完全反应,B原子核中质子数与中子数相等.回答以下问题:(1)B的相对原子质量是24,原子序数是12;
(2)A和C 的元素符号分别为Na、Al;
(3)A、B、C的单质各1mol分别与足量的稀硫酸反应,产生H2最多的是铝单质(填该单质名称),该单质产生H2的体积在标准状况下是33.6L.
分析 (1)(2)同一周期相邻的A、B、C三种元素,都是短周期元素,A的最高价氧化物的化学式是A2O,A的最高价为+1,处于ⅠA族,则B处于ⅡA族、C处于ⅢA族,11.6g B的氢氧化物恰好能与200mL 2mol/L盐酸完全反应,发生反应B(OH)2+2HCl=BCl2+2H2O,可知11.6gB(OH)2的物质的量=0.2L×2mol/L×$\frac{1}{2}$=0.2mol,故B的相对原子质量=$\frac{11.6}{0.2}$-17×2=24,B原子核中质子数与中子数相等,其质子数为12,故B为Mg,则A为Na、C为Al;
(3)结合反应金属的化合价判断产生氢气多少,根据电子转移守恒生成氢气的物质的量,再根据V=nVm计算氢气的体积.
解答 解:(1)同一周期相邻的A、B、C三种元素,都是短周期元素,A的最高价氧化物的化学式是A2O,A的最高价为+1,处于ⅠA族,则B处于ⅡA族、C处于ⅢA族,11.6g B的氢氧化物恰好能与200mL 2mol/L盐酸完全反应,发生反应B(OH)2+2HCl=BCl2+2H2O,可知11.6gB(OH)2的物质的量=0.2L×2mol/L×$\frac{1}{2}$=0.2mol,故B的相对原子质量=$\frac{11.6}{0.2}$-17×2=24,B原子核中质子数与中子数相等,其质子数为12,原子序数为12,
故答案为:24;12;
(2)由(1)分析可知,B为Mg,则A为Na、C为Al,
故答案为:Na;Al;
(3)A为Na、B为Mg,C为Al,各1mol与足量的硫酸反应,反应中Na为+1价、Mg为+2价、Al为+3价,故Al提供的电子最多,产生的氢气最多,根据电子转移守恒,生成氢气的物质的量=$\frac{1mol×3}{2}$=1.5mol,标况下,生成氢气的体积=1.5mol×22.4L/mol=33.6L,
故答案为:铝;33.6L
点评 本题考查结构性质位置关系应用,涉及元素推断、化学计算等,计算推断B是关键,(3)中注意根据电子转移判断,避免方程式的繁琐.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | 玻璃钢 | B. | 陶瓷 | C. | 二氧化硅 | D. | 聚乙烯 |
| A. | 升高温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的硫酸 |
| A. | 原子的次外层电子数都是2 | |
| B. | 稀有气体原子的最外层电子数均为8 | |
| C. | 原子的最外层电子数不超过8个 | |
| D. | 所有的原子核都是由质子和中子组成的 |
| A. | 它们是同分异构体 | |
| B. | 它们与NaOH的醇溶液共热后产物相同 | |
| C. | 它们均属多卤代烃 | |
| D. | 它们与NaOH的水溶液都能发生取代反应 |
| A. | 60.0g水晶晶体中,含有“Si-O”键的数目为NA | |
| B. | 7.8 g过氧化钠晶体中含有阴离子的数目为0.2NA | |
| C. | 18.4 g甲苯中含有碳碳双键的个数为0.6 NA | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
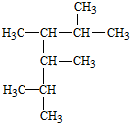 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷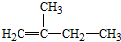 2-甲基-1-丁烯
2-甲基-1-丁烯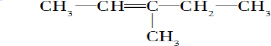 .
. .
.