题目内容
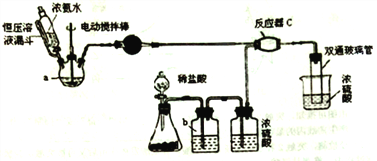
【题目】用密度为1.84 g/mL,质量分数为98%的浓硫酸配制480 mL 0.1 mol/L 稀硫酸。
(1)所需浓硫酸的体积是__________。
(2)配制过程需要的玻璃仪器有量筒、烧杯、玻璃棒、________、_________。
(3)配制溶液时,一般可以分为以下几个步骤:
①量取②计算③稀释④摇匀⑤移液⑥洗涤⑦定容⑧冷却⑨初步振荡⑩装瓶贴签
其正确的操作顺序为 ______(填序号)。
(4)第⑦步实验的操作是__________________。
(5)下列情况对所配制的稀硫酸浓度有何影响?(用字母填写a.“偏大” b.“偏小” c.“无影响”)
A.所用的浓硫酸长时间放置在密封不好的容器中_______;
B.容量瓶用蒸馏洗涤后残留有少量的水_________;
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线_________;
D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸_______________。
【答案】2.7 mL 500 mL容量瓶 胶头滴管 ②①③⑧⑤⑥⑨⑦④⑩ 定容,沿玻璃棒往容量瓶中加蒸馏水至刻度线1~2cm处,改用胶头滴管滴至凹液面与刻度线相切 b c b a
【解析】
(1)用密度为1.84 g/mL,质量分数为98%的浓硫酸配制480 mL 0.1 mol/L稀硫酸,浓硫酸的浓度是![]() =18.4mol/L,由于需要使用500mL容量瓶,则根据稀释过程中溶质的物质的量不变可知所需浓硫酸的体积是
=18.4mol/L,由于需要使用500mL容量瓶,则根据稀释过程中溶质的物质的量不变可知所需浓硫酸的体积是![]() 。
。
(2)配制的一般步骤是计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,因此配制过程需要的玻璃仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管。
(3)根据(2)中分析可知其正确的操作顺序为②①③⑧⑤⑥⑨⑦④⑩。
(4)第⑦步是定容,其实验的操作是沿玻璃棒往容量瓶中加蒸馏水至刻度线1~2cm处,改用胶头滴管滴至凹液面与刻度线相切。
(5)A.所用的浓硫酸长时间放置在密封不好的容器中会导致浓硫酸吸水,浓度减小,量取的浓硫酸中溶质减少,浓度偏小,答案选b;
B.容量瓶用蒸馏洗涤后残留有少量的水不会影响溶质的质量和溶液体积,浓度不变,答案选c;
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,溶液体积增加,浓度偏小,答案选b;
D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸,硫酸的体积增加,溶质的质量增加,浓度偏大,答案选a。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。