题目内容
【题目】常温下,Ka1(H2C2O4)=10-1.3, Ka2(H2C2O4)=10-4.2。用0.1000 mol·L-1 NaOH溶液滴定10.00 mL 0.1000 mol·L-1 H2C2O4溶液所得滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B. 点②所示溶液中:c(HC2O4-)=c(C2O42-)
C. 点③所示溶液中:c(Na+)=c(HC2O4-) + c(C2O42-)
D. 点④所示溶液中:c(Na+) + 2c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-)
【答案】BD
【解析】A. 点①所示溶液为Na HC2O4溶液,溶液呈酸性,说明HC2O4-的电离大于水解,则c(C2O42-) >c(H2C2O4),选项A错误;B、常温下,点②所示溶液中pH=4.2, ![]() ,Ka2(H2C2O4)=
,Ka2(H2C2O4)=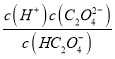 =
=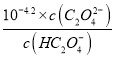 =10-4.2,故c(HC2O4-)=c(C2O42-),选项B正确;C、点③所示溶液中pH=7,
=10-4.2,故c(HC2O4-)=c(C2O42-),选项B正确;C、点③所示溶液中pH=7, ![]() ,根据电荷守恒有c(Na+)+c(H+)=c(HC2O4-) + 2c(C2O42-)+ c(OH-),则c(Na+)=c(HC2O4-) +2 c(C2O42-),选项C错误;D、点④所示的溶液的体积20mL,草酸和氢氧化钠恰好完全反应,生成正盐草酸钠,草酸钠水解,所以溶液中,c(Na+)═2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-)①,根据电荷守恒得:关系式为:c(Na+)+c(H+)=c(HC2O4-) + 2c(C2O42-)+ c(OH-)②,由①-②
,根据电荷守恒有c(Na+)+c(H+)=c(HC2O4-) + 2c(C2O42-)+ c(OH-),则c(Na+)=c(HC2O4-) +2 c(C2O42-),选项C错误;D、点④所示的溶液的体积20mL,草酸和氢氧化钠恰好完全反应,生成正盐草酸钠,草酸钠水解,所以溶液中,c(Na+)═2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-)①,根据电荷守恒得:关系式为:c(Na+)+c(H+)=c(HC2O4-) + 2c(C2O42-)+ c(OH-)②,由①-②![]() 得:c(Na+) + 2c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-),选项D正确。答案选BD。
得:c(Na+) + 2c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-),选项D正确。答案选BD。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
B | 向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
C | 室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。 | HCO3-结合H+的能力比CO32-的强 |
D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净 | 存在可逆过程: Fe3++Ag |
A. A B. B C. C D. D


