题目内容
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,可由两种常见气体制取,其易分解、易水解,可用于医药、氨化剂等。某科研小组利用以下装置制备氨基甲酸铵。回答下列问题:
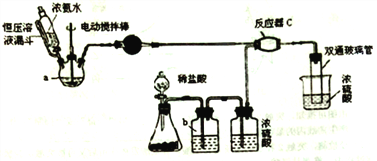
(1)写出a中的固体药品的名称________,制取氨气的原理为___________(结合化学方程式并用简要的文字加以说明)。
(2)恒压滴液漏斗的作用是________。
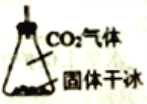
(3)有同学建议该CO2发生装置直接改用如下装置代替,你认为他的改进有何优点(试述一种): ________ 。
(4)反应器C中发生反应的化学方程式为________ 。
(5) 双通玻璃管的作用________;b中溶液的作用________ 。
(6)上述制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂: 蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸。
实验步骤
预期现象和结论
步骤1: 取少量固体样品于试管中,加入蒸馏水至固体溶解。
得到无色溶液
步骤2: 向试管中加入过量的BaCl2溶液,静置。
溶液不变浑浊,则证明固体中不含有________。
步骤3: 取步骤2的上层清液于试管中加入少量 的______。
溶液变浑浊,则证明固体中含有_______。
②根据①的结论: 取氨基甲酸铵样品15.80g,用上题步骤经充分处理后,过滤、洗涤、干燥,测得沉淀质量为5.91g 。则样品中氨基甲酸铵的质量分数为________。
【答案】 新制生石灰(NaOH固体、碱石灰均可) CaO+NH3.H2O=Ca(OH)2+NH3↑ CaO吸水且放热促进氨气生成 平衡压强,使漏斗内液体顺利滴下 装置简单,无需干燥;②低温环境,提高产率(答其中一点即可) 2NH3+CO2=H2NCOONH4 防止倒吸 吸收氯化氢气体 (NH4)2CO3 Ba(OH)2 NH4HCO3 85.0%(0.85)
【解析】由题意结合实验装置可得,三颈烧瓶中产生氨气,锥形瓶中产生CO2,经除杂干燥后的氨气和CO2在反应器C中反应生成氨基甲酸铵。
(1)恒压滴液漏斗盛有浓氨水,是利用NH3H2O受热分解产生氨气,所以a中的固体药品可以是新制生石灰(或氢氧化钠固体、碱石灰等);生石灰主要成分为CaO,滴入氨水发生反应:CaO+NH3H2O=Ca(OH)2+NH3↑,CaO吸水且放热促进氨气生成。
(2)a中产生气体,使压强增大,使用恒压滴液漏斗可以平衡漏斗与三颈烧瓶中的压强,使漏斗内液体顺利滴下。
(3)原装置,用稀盐酸与碳酸钙制取二氧化碳,需要除去HCl气体,因为氨基甲酸铵易分解、易水解,所以需要干燥,并且稀盐酸与碳酸钙的反应放热,会降低氨基甲酸铵的产率,替代装置,具备如下优点:①装置简单,无需干燥;②低温环境,提高产率等。
(4)氨气和CO2在反应器C中反应生成氨基甲酸铵,根据原子守恒,化学方程式为:2NH3+CO2=H2NCOONH4。
(5)右侧烧杯中浓硫酸的作用是:①防止C中生成的氨基甲酸铵与空气中的水蒸气接触而水解,②吸收剩余的氨气,所以双通玻璃管的作用是防止倒吸;锥形瓶中用稀盐酸与碳酸钙制取二氧化碳,二氧化碳中会有氯化氢气体,所以b的作用是吸收氯化氢气体。
(6)①碳酸铵能与BaCl2溶液反应生成BaCO3沉淀,碳酸氢铵与BaCl2溶液不反应,所以步骤2中溶液不变浑浊,则证明固体中不含(NH4)2CO3;碳酸氢铵能与Ba(OH)2溶液反应生成BaCO3沉淀,所以步骤3中加入的试剂可以是Ba(OH)2,溶液变浑浊,则证明固体中含有NH4HCO3。②由题意,氨基甲酸铵样品15.80g,BaCO3沉淀的质量为5.91g,根据碳原子守恒,n[(NH4)2CO3]=n(BaCO3)=5.91g÷197g/mol=0.03mol,m[(NH4)2CO3]=0.03mol×79g/mol=2.37g,所以样品中氨基甲酸铵的质量分数为:(15.80g-2.37g)÷15.80g×100%=85.0%。

 阅读快车系列答案
阅读快车系列答案【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
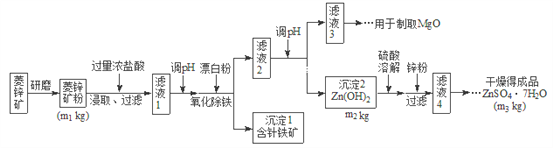
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示





