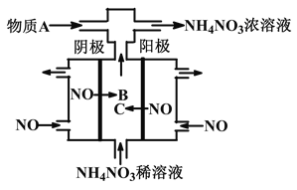
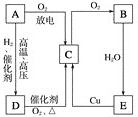
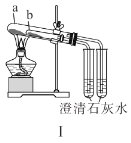
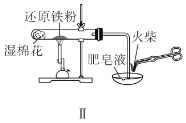
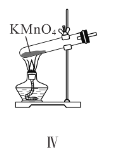
题目内容
【题目】已知HA的酸性强于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的物质的量浓度的负对数与溶液的pH的变化情况如图所示。下列说法正确的是
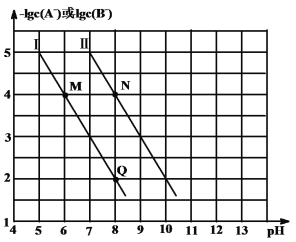
A.曲线Ⅰ表示溶液的pH与-lgc(B-)的变化关系
B.Ka(HA)∶Ka(HB)=1000∶1
C.溶液中水的电离程度:M<N
D.N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
【答案】C
【解析】
A.HA的酸性强于HB的酸性,则Ka(HA)>Ka(HB),对于HA,则Ka(HA)=![]() ,则有-lgc(A-)=-pH+pKa(HA)-lgc(HA),同理,对HB则有-lgc(B-)=-pH+pKa(HB)-lgc(HB),酸越弱,酸根离子水解越强,纵截距越大,酸越弱,所以曲线II表示pH与-1gc(B-)的关系,故A错误;
,则有-lgc(A-)=-pH+pKa(HA)-lgc(HA),同理,对HB则有-lgc(B-)=-pH+pKa(HB)-lgc(HB),酸越弱,酸根离子水解越强,纵截距越大,酸越弱,所以曲线II表示pH与-1gc(B-)的关系,故A错误;
B.对于HB,取点(10,2),则c(H+)=10-10mol/L,c(B-)=10-2mol/L,则Ka(HB)= ![]() =10-11,同理对于HA,取点(8,2),则c(H+)=10-8mol/L,c(A-)=10-2mol/L,则Ka(HA)=
=10-11,同理对于HA,取点(8,2),则c(H+)=10-8mol/L,c(A-)=10-2mol/L,则Ka(HA)= ![]() =10-9,所以Ka(HA):Ka(HB)=10-9:10-11=100,故B错误;
=10-9,所以Ka(HA):Ka(HB)=10-9:10-11=100,故B错误;
C.M点和N点溶液中c(A-)=c(B-),溶液pH越大,水的电离程度越大,所以水的电离程度M<N,故C正确;
D.对于N点溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(B-),对于Q点溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),N点和Q点溶液pH相同,则两溶液中c(H+)和c(OH-)分别相等,但c(B-)<c(A-),则N点对应的溶液中c(Na+)<Q点对应的溶液中c(Na+),故D错误;
答案:C

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案