题目内容
【题目】下列有关实验装置及操作均正确的是( )
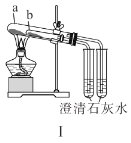

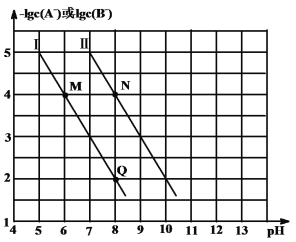
A.装置Ⅰ中![]() 盛放碳酸氢钠,
盛放碳酸氢钠,![]() 盛放碳酸钠,可对比二者的热稳定性
盛放碳酸钠,可对比二者的热稳定性
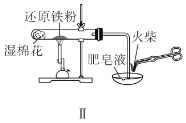
B.装置Ⅱ用于检验铁粉与水蒸气反应产生的氢气
C.装置Ⅲ用于制备氢氧化铁胶体
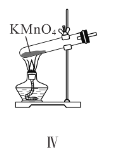
D.装置Ⅳ用于制备氧气
【答案】B
【解析】
A.装置Ⅰ中![]() 盛放碳酸钠,
盛放碳酸钠,![]() 盛放碳酸氢钠,由于碳酸氢钠的稳定性略差,分解需要的温度较低,碳酸钠的稳定性较强,需要加热的温度较高,可对比二者的热稳定性,故A错误;
盛放碳酸氢钠,由于碳酸氢钠的稳定性略差,分解需要的温度较低,碳酸钠的稳定性较强,需要加热的温度较高,可对比二者的热稳定性,故A错误;
B.湿棉花可以产生水蒸气,水蒸气在高温下与铁粉反应生成四氧化三铁和氢气,氢气吹入肥皂液中起泡,泡沫中是氢气,用火柴点燃,可以产生蓝色火焰,并产生轻微的爆鸣声,故B正确;
C.制备氢氧化铁胶体是将饱和三氯化铁溶液加入沸水中,如加入到氢氧化钠溶液中,会产生氢氧化铁沉淀,得不到胶体,故C错误;
D.制备氧气时用加热高锰酸钾的方法可以得到锰酸钾,二氧化锰和氧气,加热时试管口略向下倾斜,防止加热时产生的水留在试管底部,使试管炸裂,故D错误;
答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目