题目内容
11. 实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.
实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.(1)请补充完整实验的简要步骤:
①计算;②称量胆矾(CuSO4.5H2O)固体12.5 g;③溶解;④冷却并移液;⑤洗涤并转移;⑥定容;⑦摇匀.
(2)本实验用到的基本仪器已有烧杯、天平(带砝码)、镊子、量筒、玻璃棒,还缺少的仪器是500mL容量瓶、胶头滴管.
(3)上述实验操作③④都要用到玻璃棒,其作用分别是搅拌和引流.
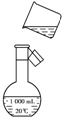
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
①应选用500mL的容量瓶;②没有用玻璃棒引流.
(5)试分析下列操作对所配溶液的浓度有何影响.(填“偏高”“偏低”或“无影响”)
a.为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容.导致所配溶液浓度偏高.
b.定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度.导致所配溶液浓度偏低
c.定容时俯视液面,导致所配溶液浓度偏高
d.转移溶液时不慎有少量液体洒到容量瓶外面,导致所配溶液浓度偏低
e.称量时左盘放砝码右盘放药品,致所配溶液浓度偏低
f.移液前容量瓶中有少量蒸馏水,致所配溶液浓度无影响
(6)某同学从该溶液中取出50mL,其中CuSO4的物质的量浓度为0.1mol/L.
分析 (1)②由于实验室无480mL容量瓶,故应选用500mL容量瓶,配制出500mL溶液,求出溶液中硫酸铜的物质的量n=CV=0.1mol/L×0.5L=0.05mol,然后根据1mol胆矾能提供1mol硫酸铜,据此分析计算所需的胆矾的物质的量和质量;
⑥根据配制一定物质的量浓度溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析实验步骤;
(2)根据配制一定物质的量浓度溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析所需的仪器;
(3)根据实验操作的目的来分析玻璃棒的用途;
(4)容量瓶只有一条刻度线,只能用容量瓶配制和其规格相对应的体积的溶液;移液时必须要用玻璃棒引流;
(5)分析具体操作对n、V的影响,根据c=$\frac{n}{V}$分析不当操作对溶液浓度的影响;
(6)溶液是均一稳定的,浓度与所取的体积无关.
解答 解:(1)②由于实验室无480mL容量瓶,故应选用500mL容量瓶,配制出500mL溶液,所配溶液中硫酸铜的物质的量n=CV=0.1mol/L×0.5L=0.05mol,而1mol胆矾能提供1mol硫酸铜,故所需的胆矾的物质的量为0.05mol,质量m=nM=0.05mol×250g/mol=12.5g,故答案为:12.5;
⑥根据配制一定物质的量浓度溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知此步实验操作是定容,故答案为:定容;
(2)根据配制一定物质的量浓度溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶和胶头滴管,故还缺少的仪器是500 mL容量瓶和胶头滴管,故答案为:500 mL容量瓶;胶头滴管;
(3)在第③步的实验操作中,使用玻璃棒来搅拌,目的是加快溶解;在第④步中玻璃棒的作用是引流,防止溶液溅出,故答案为:搅拌;引流;
(4)容量瓶只有一条刻度线,只能用容量瓶配制和其规格相对应的体积的溶液,故要配制480mL的溶液,应选用500mL容量瓶;移液时必须要用玻璃棒引流;故答案为:①应选用500 mL的容量瓶;②没有用玻璃棒引流;
(5)a.在未降至室温时,立即将溶液转移至容量瓶定容,则冷却后溶液体积偏小,导致所配溶液浓度偏高,故答案为:偏高;
b.定容后,加盖倒转摇匀后,发现液面低于刻度线是正常的,又滴加蒸馏水至刻度.导致所配溶液浓度偏低,故答案为:偏低;
c.定容时俯视液面,则溶液体积偏小,导致所配溶液浓度偏高,故答案为;偏高;
d.转移溶液时不慎有少量液体洒到容量瓶外面,导致溶质损失,则所配溶液浓度偏低,故答案为:偏低;
e.称量时左盘放砝码右盘放药品,致所称量的药品的质量偏小,所配溶液浓度偏低,故答案为:偏低;
f.移液前容量瓶中有少量蒸馏水,对所配溶液的浓度无影响,故答案为:无影响;
(6)溶液是均一稳定的,浓度与所取的体积无关,故从该溶液中取出50mL,其中CuSO4的物质的量浓度为0.1mol/L,故答案为:0.1mol/L.
点评 本题考查了一定物质的量浓度溶液的配制与有关计算,比较基础,注意操作的步骤与注意事项.

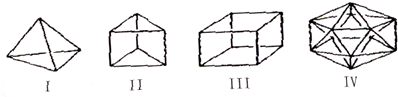
| A. | Ⅳ不可能合成得到 | B. | Ⅱ与苯互为同分异构体 | ||
| C. | Ⅲ(立方烷)的六氯代物共有3种 | D. | Ⅰ中各键之间夹角为109°28′ |
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 任何物质的摩尔质量就等于它的相对分子质量或相对原子质量 | |
| C. | 物质的量实质上是物质的质量 | |
| D. | 1mol H2SO4中含有2mol H、1mol S和4mol O |
| A. | 氧化产物与还原产物的粒子个数比为5:2 | |
| B. | 氧化产物与还原产物的粒子个数比为2:5 | |
| C. | 氧化剂与还原剂的粒子个数之比为1:8 | |
| D. | 氧化剂与还原剂的粒子个数之比为1:5 |
| A. | CO2 | B. | Al | C. | 食盐水 | D. | BaSO4 |
| A. | 1种 | B. | 2种 | C. | 3 种 | D. | 4种 |
 (1)一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志之一.请列举出乙烯的两种重要用途:①生产聚乙烯,②果实催熟;
(1)一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志之一.请列举出乙烯的两种重要用途:①生产聚乙烯,②果实催熟;