题目内容
16.用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+4HNO3+O2↑;若在阳极收集到0.32g O2,中和电解生成的酸需0.4mol•L-1NaOH溶液100mL.分析 用惰性电极电解AgNO3溶液,阳极发生4OH--4e-=2H2O+O2↑,阴极发生4Ag++4e-=4Ag,所以电解总方程:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+4HNO3+O2↑,根据产生氧气的量计算产生硝酸的量,根据硝酸和氢氧化钠的量之间的关系来计算.
解答 解:用惰性电极电解AgNO3溶液,阳极发生4OH--4e-=2H2O+O2↑,阴极发生4Ag++4e-=4Ag,所以电解总方程:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+4HNO3+O2↑,在阳极上收集到0.32gO2即0.01mol氧气(标准状况下),转移电子是0.04mol,根据反应:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+4HNO3+O2↑,生成硝酸是0.04mol,消耗0.04mol氢氧化钠来将之中和,所以NaOH溶液的物质的量浓度为$\frac{0.04mol}{0.4mol•L{\;}^{-1}}$=0.1L=100ml.故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+4HNO3+O2↑;100.
点评 本题考查学生电解池的工作原理以及电池反应的应用和计算,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.自然界中只能以化合态存在的元素是( )
| A. | 硫 | B. | 氧 | C. | 氮 | D. | 铝 |
4.某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中氧原子的个数可以是( )
| A. | 1到4 | B. | 2或3 | C. | 只有4 | D. | 1或4 |
1.下列各组离子,能在指定溶液中大量共存的是( )
| A. | 无色溶液中:Na+、SO42-、CO32-、Cl- | |
| B. | 能使紫色石蕊试剂变红的溶液中:OH-、K+、Ba2+、Na+ | |
| C. | 透明的酸性溶液中:Fe3+、Mg2+、Cl-、NO3- | |
| D. | 碱性溶液中:NH4+、Ba2+、Cl-、CO32- |
8.对于易燃易爆有毒的化学物质,往往会在其包装上贴危险警告标签.下图所列物质,贴错了包装标签的是( )
| A. |  白磷 | B. |  高锰酸钾 | C. |  过氧化氢 | D. |  浓硫酸 |
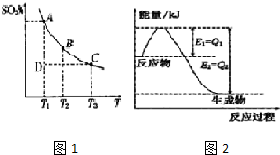
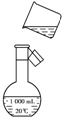 实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.
实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.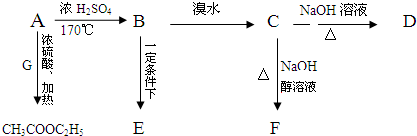
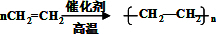 ,反应类型加聚反应
,反应类型加聚反应