题目内容
11.下列说法中不正确的是( )| A. | 非金属元素之间形成的化合物不一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 在共价化合物中也可能含有离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
分析 A.铵盐为离子化合物;
B.离子化合物中一定含有离子键,可能含有共价键;
C.共价化合物中一定不含离子键;
D.离子化合物中一定含有离子键.
解答 解:A.铵盐是由非金属元素之间形成的化合物,为离子化合物,一般非金属元素之间形成共价化合物,故A正确;
B.离子化合物中一定含有离子键,可能含有共价键,如NaOH中含有离子键和共价键,属于离子化合物,故B正确;
C.共价化合物中一定不含离子键,含有离子键的化合物属于离子化合物,故C错误;
D.离子化合物中一定含有离子键,则含有离子键的化合物一定是离子化合物,故D正确;
故选C.
点评 本题考查化学键,明确化学键的形成规律及离子化合物、共价化合物的关系即可解答,注意利用实例来分析解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.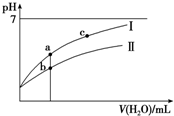 已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
 已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
2.向硝酸钠溶液中加入铜粉不发生反应,若再加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是( )
| A. | ZnSO4 | B. | NaHCO3 | C. | NaHSO4 | D. | Fe(NO3)2 |
19.下列各组气体通常条件下能稳定共存( )
| A. | NH3 O2 HCl | B. | H2S O2 SO2 | C. | CO2 HI Cl2 | D. | N2 H2 HCl |
16.已知反应A(g)+3B(g)═2C(g)+D(g)在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L•min),则此段时间内以C的浓度变化表示的化学反应速率为( )
| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
1.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 加水稀释$\frac{c(O{H}^{-})}{c({H}^{+})}$增大的溶液:K+、Na+、SO42-、AlO2- | |
| B. | 常温下$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| C. | 铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3- | |
| D. | NaHCO3溶液:K+、Na+、SO42-、Al3+ |
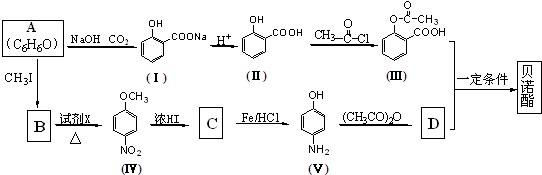
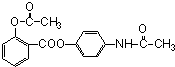
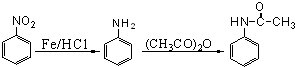
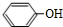 ;
; 或
或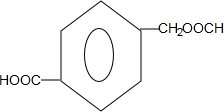 ;
;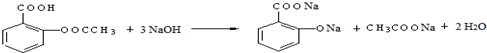 ;
;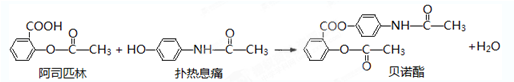 .
.