题目内容
6.酸雨是因为过度燃烧煤和石油,生成的硫的氧化物与氮的氧化物溶于水生成硫酸和硝酸的缘故.某次雨水的分析数据如下:[NH4+]=2.0×10-5mol/L、[Cl-]=6.0×10-5mol/L、[Na+]=1.9×10-5mol/L
[NO3-]=2.3×10-5mol/L,[SO42-]=2.8×10-5mol/L
则此次雨水的pH大约为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 溶液中一定满足电荷守恒,根据溶液中电荷守恒计算酸雨中氢离子浓度,然后根据pH的计算公式pH=-lg[H+]计算该酸雨的pH,注意酸雨中的氢氧根离子可以忽略不计.
解答 解:溶液中阴阳离子所带电荷相等,设氢离子浓度为c,氢氧根离子可以忽略不计,
则:[NH4+]+[Na+]+[H+]=[NO3-]+2×[SO42-]+[Cl-],
即:2×10-5mol/L+1.9×10-5mol/L+c=2.3×10-5mol/L+2×2.8×10-5mol/L+6×10-5mol/L,
解得:c=10-4mol/L,
则该酸雨的pH=-lg10-4=4,
故选B.
点评 本题考查了溶液的pH的简单计算,题目难度中等,明确溶液中阴阳离子所带电荷相等是解本题的关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
14.下列电子式中正确的是( )
①氧原子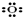 ②过氧根离子
②过氧根离子 ③氢氧根离子
③氢氧根离子 ④钠离子[Na]+
④钠离子[Na]+
⑤氢离子H+⑥铵根离子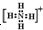 ⑦铝原子
⑦铝原子 ⑧溴负离子
⑧溴负离子
①氧原子
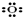 ②过氧根离子
②过氧根离子 ③氢氧根离子
③氢氧根离子 ④钠离子[Na]+
④钠离子[Na]+⑤氢离子H+⑥铵根离子
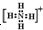 ⑦铝原子
⑦铝原子 ⑧溴负离子
⑧溴负离子
| A. | ①②③⑥⑦ | B. | ③④⑥⑦⑧ | C. | ③⑤⑥⑦⑧ | D. | ②③④⑦⑧ |
1.把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
| A. | 稀H2SO4 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Fe2(SO4)3溶液 |
11.下列说法中不正确的是( )
| A. | 非金属元素之间形成的化合物不一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 在共价化合物中也可能含有离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
18.将4mol A和2mol B放入2L密闭容器中发生反应:2A(g)+B(g)?2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L.下列说法正确的是( )
| A. | 4 s内,v(B)=0.075 mol/(L•s) | |
| B. | 4 s后平衡状态下,c(A):c(C)=2:1 | |
| C. | 达到平衡状态时,若只升高温度,则C的物质的量浓度增大 | |
| D. | 达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低 |
15.如表实验“操作和现象”与“结论”对应关系不相符的是( )
| 选项 | 操作和现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在试管口观察到红棕色气体 | 发生反应先生成NO,进而与O2反应生成NO2 |
| B | 取皂化反应的混合液滴入盛水的烧杯中,出现油滴 | 皂化反应完全 |
| C | 在溴乙烷中加入NaOH的乙醇溶液并加热,将产生的气体依次通过水、酸性KMnO4溶液,KMnO4溶液紫红色褪色 | 使KMnO4溶液褪色的气体是乙烯 |
| D | 向漂白粉溶液中通入过量的二氧化硫,溶液变浑浊 | 析出了硫酸钙 |
| A. | A | B. | B | C. | C | D. | D |
 .
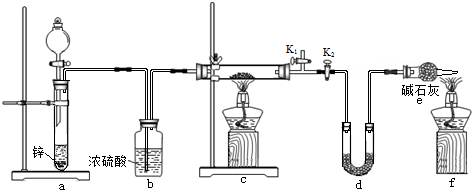
.
 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.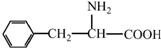 是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
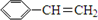 .
.
 .
.