题目内容
19.下列各组气体通常条件下能稳定共存( )| A. | NH3 O2 HCl | B. | H2S O2 SO2 | C. | CO2 HI Cl2 | D. | N2 H2 HCl |
分析 如气体之间发生化合、氧化还原反应等反应,则可稳定共存,结合对应气体的性质解答该题.
解答 解:A.NH3、HCl反应生成氯化铵,故A错误;
B.H2S与O2、SO2 发生氧化还原反应生成S,不能大量共存,故B错误;
C.HI、Cl2发生氧化还原反应生成碘和氯化氢,故C错误;
D.气体之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力和双基的考查,本题较为基础,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
相关题目
9.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1,.0mol•L-1计算).
(1)“粉碎”的目的是增大接触面积,加快反应速率;提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(1)“粉碎”的目的是增大接触面积,加快反应速率;提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).
14.下列电子式中正确的是( )
①氧原子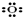 ②过氧根离子
②过氧根离子 ③氢氧根离子
③氢氧根离子 ④钠离子[Na]+
④钠离子[Na]+
⑤氢离子H+⑥铵根离子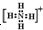 ⑦铝原子
⑦铝原子 ⑧溴负离子
⑧溴负离子
①氧原子
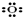 ②过氧根离子
②过氧根离子 ③氢氧根离子
③氢氧根离子 ④钠离子[Na]+
④钠离子[Na]+⑤氢离子H+⑥铵根离子
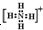 ⑦铝原子
⑦铝原子 ⑧溴负离子
⑧溴负离子
| A. | ①②③⑥⑦ | B. | ③④⑥⑦⑧ | C. | ③⑤⑥⑦⑧ | D. | ②③④⑦⑧ |
4.FeS2与硝酸反应产物有Fe3+和H2SO4,若反应中FeS2和HNO3物质的量之比是1:8时,则HNO3的唯一还原产物是( )
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
11.下列说法中不正确的是( )
| A. | 非金属元素之间形成的化合物不一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 在共价化合物中也可能含有离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
8. 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
9.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 锂(Li)的密度比钠小,锂的熔沸点也比钠低 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |

 .
. 白磷结构如图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键的数目是( )
白磷结构如图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键的数目是( )