题目内容
17.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1pH=4的NaHA溶液中:c(Na+)=c(HA-)+2c(A2-) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | pH相等的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | NH3•H2O和NH4Cl的混合溶液[pH=7,c(Cl-)=0.1 mol•L-1]:c(NH4+)>c(Cl-)>c(H+)=c(OH-) |
分析 A.常温下0.1 mol•L-1的NaHA溶液pH=4,说明HA-的电离程度大于水解程度,任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
C.pH相等的这几种钠盐,弱酸根离子水解程度越大,钠盐浓度越小;
D.混合溶液pH=7,溶液呈中性,则溶液中存在c(H+)=c(OH-),根据电荷守恒判断c(NH4+)、c(Cl-)相对大小.
解答 解:A.常温下0.1 mol•L-1的NaHA溶液pH=4,说明HA-的电离程度大于水解程度,任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),溶液呈酸性,所以c(H+)>c(OH-),则存在c(Na+)<c(HA-)+2c(A2-),故A错误;
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),根据物料守恒得c(Na+)=c(H2CO3)+2c(HCO3-)+2c(CO32-),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B错误;
C.pH相等的这几种钠盐,弱酸根离子水解程度越大,钠盐浓度越小,水解程度 ①<②<③,则三种盐溶液浓度 ①>②>③,根据钠原子守恒得c(Na+):①>②>③,故C正确;
D.混合溶液pH=7,溶液呈中性,则溶液中存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,涉及盐类水解、弱电解质的电离,明确溶液中溶质及其性质是解本题关键,注意电荷守恒和物料守恒的灵活运用.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | 加入银氨溶液,在水浴上加热 | |
| B. | 加入二至三滴紫色石蕊试液 | |
| C. | 先蒸馏,然后对蒸出的物质的水溶液进行银镜反应实验 | |
| D. | 先加入足量的NaOH溶液,然后蒸馏,对蒸出的物质的水溶液进行银镜反应实验 |
| A. | 使用氢能源代替化石燃料,减少CO2排放 | |
| B. | 就地在田间焚烧秸秆,减少运输成本 | |
| C. | 改进汽车尾气净化技术,减少污染物的排放 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
| A. | NO2与水的反应:3NO2+H2O═2H++2NO3-+NO | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| C. | 醋酸溶液与水垢中的CaCO3反应:2H++CaCO3═Ca2++H2O+CO2↑ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
| A. | 3mol | B. | 4mol | C. | 5mol | D. | 6mol |
| A. | 42 | B. | 47 | C. | 52 | D. | 94 |
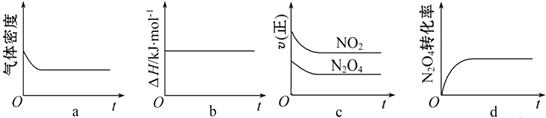
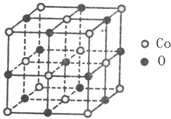 我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.
我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域. .
.