题目内容
2. 我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.
我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.(1)蓝色无水CoCl2在潮湿的空气中逐渐变为粉红色,这一性质用在做干燥剂的硅胶中和制备显隐墨水,Co2+基态的电子排布式可表示为1s22s22p63s23p63d7.
(2)钴的配合物很多,对钴的配合物的立体化学也研究得很多,例如,分子式为Co(NH3)5BrSO4有两种配合物,一种是红色的[CoSO4 (NH3)5]Br,另一种是紫色的[Co(NH3)5Br]SO4.
①NH3分子中氮原子的杂化轨道类型为sp3杂化;
②N、O、S第一电离能由大到小的顺序为N>O>S;
③写出一种与SO42-互为等电子体的分子的化学式为CCl4或SiCl4;
④1mol[Co(NH3)5Br]2+中含有σ键的数目为21×6.02×1023个(或21mol).
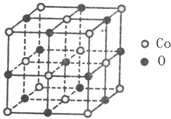
(3)元素Co的一种氧化物晶体的晶胞结构如图所示,则该化合物的化学式为CoO.
分析 (1)钴为27号元素,根据核外电子排布规律书写基态的电子排布式;
(2)①根据NH3分子中氮原子的价层电子对判断杂化轨道类型;
②元素的非金属性越强,第一电离能越大,但氮原子最外层的电子处于半满状态,是一种稳定结构,第一电离能高于同周期的相邻元素;
③原子数和价电子数都相等的微粒互为等电子体;
④1mol[Co(NH3)5Br]2+中钴离子与氨分子及溴原子之间有配位键,也是σ键,每个氨分子内有3个σ键,据此计算;
(3)利用均摊法,根据晶胞结构可知,晶胞中含有氧原子数为1+12×$\frac{1}{4}$=4,钴原子数为8×$\frac{1}{8}+6×\frac{1}{2}$=4,据此计算出晶胞中钴原子与氧原子个数之比,进而判断化学式;
解答 解:(1)钴为27号元素,根据核外电子排布规律可知,Co2+基态的电子排布式为1s22s22p63s23p63d7,
故答案为:1s22s22p63s23p63d7;
(2)①根据NH3分子中氮原子的价层电子对数为$\frac{5+3}{2}$=4,所以氮原子杂化轨道类型为sp3杂化,
故答案为:sp3杂化;
②元素的非金属性越强,第一电离能越大,但氮原子最外层的电子处于半满状态,是一种稳定结构,第一电离能高于同周期的相邻元素,所以N、O、S第一电离能由大到小的顺序为N>O>S,
故答案为:N>O>S;
③原子数和价电子数都相等的微粒互为等电子体,与SO42-互为等电子体的分子的化学式为CCl4 或SiCl4,
故答案为:CCl4 或SiCl4;
④1mol[Co(NH3)5Br]2+中钴离子与氨分子及溴原子之间有配位键,也是σ键,每个氨分子内有3个σ键,所以1mol[Co(NH3)5Br]2+中含有σ键的数目为21×6.02×1023个(或21mol),
故答案为:21×6.02×1023个(或21mol);
(3)利用均摊法,根据晶胞结构可知,晶胞中含有氧原子数为1+12×$\frac{1}{4}$=4,钴原子数为8×$\frac{1}{8}+6×\frac{1}{2}$=4,晶胞中钴原子与氧原子个数之比为1:1,所以化学式为CoO,
故答案为:CoO.
点评 本题考查核外电子排布规律、第一电离能、晶胞计算、配合物的成键情况,侧重考查学生分析、计算能力及空间想象能力,利用均摊法计算晶胞,明确物质內界、外界的性质即可解答,题目难度中等.

| A. | 1.0 mol•L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1的NaOH溶液中:Na+、NH4+、Cl-、HCO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:Ca2+、K+、ClO-、NO3- |
| A. | 0.1 mol•L-1pH=4的NaHA溶液中:c(Na+)=c(HA-)+2c(A2-) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | pH相等的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | NH3•H2O和NH4Cl的混合溶液[pH=7,c(Cl-)=0.1 mol•L-1]:c(NH4+)>c(Cl-)>c(H+)=c(OH-) |
| A. | 氧化还原反应的特征是电子的转移 | |
| B. | 物质中某元素失去电子,则此物质是还原剂 | |
| C. | 有单质参与的反应一定是氧化还原反应 | |
| D. | 同种元素的价态越高,其氧化性一定越强 |
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆反应速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
| A. | 30mL | B. | 70mL | C. | 90mL | D. | 140mL |
| A. | 同位素:1H2、2H2、3H2 | B. | 分子晶体:I2、SO3、固态氩 | ||
| C. | 非电解质:Cl2、BaSO4、C2H5OH | D. | 化合物:重水、双氧水、矿泉水 |