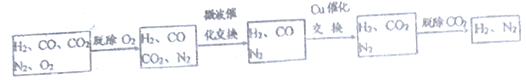
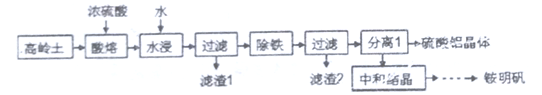
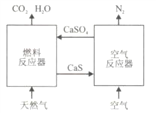
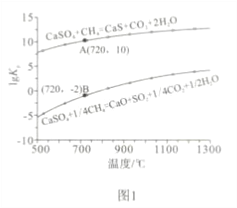
题目内容
【题目】某化学实验室需要0.5 mol·L-1硫酸溶液450 mL。根据溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制450 mL、0.5 mol·L-1的稀硫酸。计算所需浓硫酸的体积为________ mL(保留1位小数),现有
①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________________________________________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→________→ ________→________→________→④(填序号)。_________
(5)在配制过程中,其他操作都准确,下列操作中错误的是________(填代号,下同),能引起误差偏高的有________。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
【答案】AD玻璃棒、胶头滴管13.6②将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌⑧ ⑤ ⑥ ⑦①②③④⑥⑦①②⑦
【解析】
(1)A为平底烧瓶、D为分液漏斗,在配制溶液过程中不会用到烧瓶和分液漏斗,答案选AD;配制一定浓度的溶液还缺少玻璃棒和胶头滴管;(2)质量分数为98%、密度为1.84 g·cm-3的浓硫酸的浓度为![]() mol·L-1=18.4 mol·L-1;实验室没有450 mL的容量瓶,实际上配制的是500 mL 0.5 mol·L-1的硫酸溶液,需要浓硫酸的体积为
mol·L-1=18.4 mol·L-1;实验室没有450 mL的容量瓶,实际上配制的是500 mL 0.5 mol·L-1的硫酸溶液,需要浓硫酸的体积为![]() ≈0.013 6 L=13.6 mL;(3)稀释浓硫酸时必须将浓硫酸加入水中,正确的操作方法为将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌;(4)配制一定物质的量浓度的溶液的步骤为计算、称量(量取)、溶解(稀释)、冷却、移液、洗涤、定容、摇匀,故正确的操作顺序为②→①→③→⑧→⑤→⑥→⑦→④;(5)①错误,原因:量筒不应洗涤,会引起浓度偏高;②错误,原因:温度偏高热胀冷缩,所以在定容时水加少了,导致配制的溶液的物质的量浓度偏高;③错误,原因:应该将浓硫酸缓慢加入水中,而不是将水加入浓硫酸中,这样会喷溅,有危险性;④错误,原因:水加多了,导致溶液的物质的量浓度偏小;⑥错误,原因:定容之后就不能加入水了;⑦错误,原因:应该视线与刻度线相平,俯视会导致加水偏少,浓度偏高。故操作中错误的是①②③④⑥⑦;能引起误差偏高的有①②⑦。
≈0.013 6 L=13.6 mL;(3)稀释浓硫酸时必须将浓硫酸加入水中,正确的操作方法为将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌;(4)配制一定物质的量浓度的溶液的步骤为计算、称量(量取)、溶解(稀释)、冷却、移液、洗涤、定容、摇匀,故正确的操作顺序为②→①→③→⑧→⑤→⑥→⑦→④;(5)①错误,原因:量筒不应洗涤,会引起浓度偏高;②错误,原因:温度偏高热胀冷缩,所以在定容时水加少了,导致配制的溶液的物质的量浓度偏高;③错误,原因:应该将浓硫酸缓慢加入水中,而不是将水加入浓硫酸中,这样会喷溅,有危险性;④错误,原因:水加多了,导致溶液的物质的量浓度偏小;⑥错误,原因:定容之后就不能加入水了;⑦错误,原因:应该视线与刻度线相平,俯视会导致加水偏少,浓度偏高。故操作中错误的是①②③④⑥⑦;能引起误差偏高的有①②⑦。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】下列实验操作能达到实验目的的是( )
序号 | 实验操作 | 实验目的 |
① | 滴加酸性高锰酸钾溶液 | 确定苯中混有乙醛 |
② | 向水解后的蔗糖溶液中直接加入新制氢氧化铜悬浊液并加热 | 确定蔗糖是否水解 |
③ | 加入碳酸氢钠溶液 | 确定乙醇中混有乙酸 |
④ | 加淀粉 | 确定食盐中含有碘酸钾 |
A. ①② B. ②③ C. ①③ D. ②④
【题目】下列①、②对应的试剂(或条件)不能完成实验目的的是 ( )
实验目的 | 试剂(或条件) |
| |
A | 温度对Na2S2O3与H2SO4反应速率的影响 | ①热水浴 ②冷水浴 | |
B | 用酸化的AgNO3溶液检验自来水中Cl-是否蒸馏除去 | ①自来水 ②蒸馏水 | |
C | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇 ②煤油 | |
D | 用溴水检验苯的同系物中取代基对苯基活性有影响 | ①苯 ②甲苯 |
A. A B. B C. C D. D