题目内容
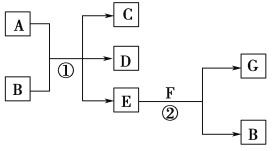
【题目】在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
回答下列问题:
(1)A、G的化学式分别为________、________。
(2)写出反应②的化学方程式:___________________________________。
【答案】Cl2O22Na2O2+2H2O===4NaOH+O2↑
【解析】
E常温下为无色无味的液体,应为H2O,F为淡黄色粉末,应为Na2O2,则G为O2,B为NaOH,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,应为Cl2和NaOH的反应,生成NaCl和NaClO,结合物质的性质结合该题。
该题的突破口在于E和F的反应,E为常温下无色无味的液体,F为淡黄色粉末,则E为H2O,F为Na2O2,产生的无色气体G为氧气,B为NaOH,再结合A和B的反应,即可确定A为氯气。(1)由以上分析可知A为Cl2,G为O2;(2)反应②为过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目