题目内容
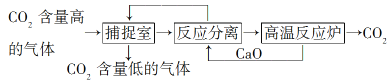
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够髙效低能耗地实现CO2的分离和捕获其原理如下图所示:
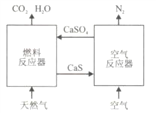
(1)已知在燃料反应器中发生如下反应:
i.CaSO4(g)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_____________(填“i”“ ii”或“ⅲ”)。
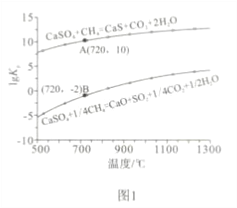
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_____________ 0(填“>”“ =” 或“<”);720℃时反应ⅲ的平衡常数Kp=_________________。

③下列措施可提高反应ii中甲烷平衡转化率的是______________ 。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃-900℃之间,从化学反应原理的角度说明原因:
________________________。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为 __________________(填“吸热”或“放热”) 反应。
(4)该原理总反应的热化学方程式为_____________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如右图所示,请回答:

25℃时向50mL的Sn2+、Cu2+浓度均为0.01 mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为___________mol/L。
【答案】 ii > 1.0×10-18 B 温度过低,反应速率较慢;温度较高,副反应增多 放热 CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol或ΔH=(a-c+d)kI/mol 2.5×10-13
【解析】(1)①:反应ii中生成的CaS在反应ⅲ中继续反应,有利于反应ii的正向进行,反应的程度大,故ii反应是主要反应;②:反应i的lgK随着温度的升高增大,所以K也增大,平衡正向移动,所以正反应是吸热反应,a>0;反应ⅲ= 反应i-反应ii,所以反应ⅲ的平衡常数Kp=Kpi/ Kp ii=(10-2)4÷1010=10-18;③:A、增加CaSO4固体的投入量对平衡无影响; B、将水蒸气冷凝,生成物的浓度减小,平衡正向移动,CH4的转化率增大;C、反应 ii的平衡常数随温度降低而降低,即降温平衡逆向移动,CH4的转化率减小;D、增大甲烷流量,平衡正向移动,但CH4的转化率反而减小。故可提高反应ii中甲烷平衡转化率的是B。
(2)温度较低时,CaS的摩尔分数虽然较大,但反应速率太慢,温度太高时,副产物CaO的含量较大,即副反应增多,故答案为:温度过低,反应速率较慢;温度较高,副反应增多。
(3) ①CaS(s) +2O2(g)=CaSO4(s)是一个熵减的自发反应,ΔS<0,根据吉布斯自由能ΔG=ΔH-TΔS<0,可知ΔH<0,所以该反应正反应一定是放热反应。
(4) 对于CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g)ΔH2=bkJ/mol和CaS(s)+2O2(g)=CaSO4(s) ΔH4=dkJ/mol,两个热化学方程式相加可得甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol,因为反应ⅲ= 反应i-反应ii,所以焓变关系有c=a-b,故有b=a-c,故ΔH=(b+d)kJ/mol=(a-c+d)kI/mol,答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol或ΔH=(a-c+d)kI/mol。
(5)两条曲线均是溶解平衡曲线,lgc(Sn2+)+lgc(S2-)=-25,所以Ksp(SnS)=10-25, lgc(Cu2+)+lgc(S2-)=-35,所以Ksp(CuS)=10-35。向50mL的Sn2+、Cu2+浓度均为0.01 mol/L的混合溶液中逐滴加入150mL Na2S溶液时,Sn2+的浓度为0.01/4(mol/L),此时Sn2+开始沉淀,则c(S2-)= Ksp(SnS)÷c(Sn2+)=10-25÷0.01/4(mol/L)=4×10-23 mol/L,所以c(Cu2+)= Ksp(CuS)÷c(S2-)=10-35÷(4×10-23 )mol/L=2.5×10-13。