题目内容
4.下列对反应2H2SO4+Cu→CuSO4+SO2↑+2H2O的说法中正确的是( )| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 氧化产物与还原产物的物质的量之比为1:1 | |
| C. | 该反应说明Cu的金属性很强 | |
| D. | 2mol H2SO4参与反应时,有4 mol电子发生转移 |
分析 2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中,Cu元素的化合价升高,Cu为还原剂,CuSO4为氧化产物,S元素的化合价降低,H2SO4为氧化剂,SO2为还原产物,结合氧化还原反应基本概念来解答.
解答 解:A.反应中Cu为还原剂,H2SO4为氧化剂,2molH2SO4中只有1mol作氧化剂,则氧化剂与还原剂的物质的量之比为1:1,故A错误;
B.CuSO4为氧化产物,SO2为还原产物,则氧化产物与还原产物的物质的量之比为1:1,故B错误;
C.反应常温下不能进行,则说明Cu的活泼性较弱,故C正确;
D.1molCu与2mol H2SO4反应,Cu从0价升高为+2价,则2mol H2SO4参与反应时,有2 mol电子发生转移,故D错误;
故选B.
点评 本题考查氧化还原反应,把握常见的反应及反应中元素的化合价变化为解答的关键,侧重基本概念的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
相关题目
14.磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物有着广泛的应用.
(1)2P(s)+3Cl2(g)═2PCl3(g)△H=-612kJ/mol
P(s)+5/2Cl2(g)═PCl5(g)△H=-399kJ/mol
写出PCl5分解成PCl3和Cl2的热化学方程式是PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1.
(2)PCl5分解成PCl3和Cl2的反应是可逆反应.T℃时,向2.0L恒容密闭容器中充入1.0mol PCl5,经过250s达到平衡.反应过程中测定的部分数据见下表:
反应在50~150s 内的平均速率v(PCl3)=1.5×10-4mol/(L•s).
(1)2P(s)+3Cl2(g)═2PCl3(g)△H=-612kJ/mol
P(s)+5/2Cl2(g)═PCl5(g)△H=-399kJ/mol
写出PCl5分解成PCl3和Cl2的热化学方程式是PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1.
(2)PCl5分解成PCl3和Cl2的反应是可逆反应.T℃时,向2.0L恒容密闭容器中充入1.0mol PCl5,经过250s达到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
15.下列事实不能用电化学原理解释的是( )
| A. | 铁片在潮湿的环境中生锈 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 银制器皿露置在空气中发黑 | |
| D. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
19.已知,aK(n-1)+、bLn+、cWn-、dD(n+1)-具有相同的电子层结构,关于K、L、W、D四种元素的叙述正确的是( )
| A. | 气态氢化物的稳定性:D>W | |
| B. | 四种元素一定属于短周期元素 | |
| C. | 最高价氧化物对应水化物的碱性:L>K | |
| D. | 原子序数:L>K>W>D |
16.在元素周期表中,第一、二、三周期中所含元素种数分别为( )
| A. | 2、8、8 | B. | 8、8、18 | C. | 2、8、18 | D. | 8、18、18 |
13.下列叙述中正确的是( )
| A. | 相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 | |
| B. | 标准状况下,28 g CO和22.4 L SO3所含分子数相等 | |
| C. | 5.6 g铁粉与足量氯气充分反应,有0.2 mol电子转移 | |
| D. | 等物质的量的CH${\;}_{5}^{+}$和NH${\;}_{2}^{-}$所含电子数相等 |

 <
<  (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同)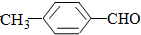 <
<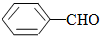
 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性)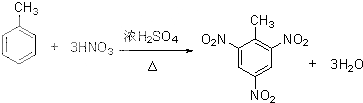 ;
; +nHCHO
+nHCHO 
 +nH2O.
+nH2O. 草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图: