题目内容
9.一包含有NH4NO3和(NH4)2SO4的白色固体样品21.2克,加适量水溶解后,加入过量的NaOH溶液并加热,收集到6.72L气体(标准状况)1)写出溶液中发生反应的化学方程式
2)求样品中NH4NO3和(NH4)2SO4的物质的量各为多少?要求写出计算过程.
分析 (1)发生反应有:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O、NH4NO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaNO3+NH3↑+H2O;
(2)设出样品中NH4NO3和(NH4)2SO4的物质的量,分别根据总质量、生成氨气的物质的量列式计算.
解答 解:(1)溶液中硝酸铵、硫酸铵分别与氢氧化钠溶液发生的反应方程式为:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O、NH4NO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaNO3+NH3↑+H2O,
答:溶液中发生反应的化学方程式为(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O、NH4NO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaNO3+NH3↑+H2O;
(2)溶液中发生反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
标准状况下6.72L氨气的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,
设混合物中硝酸铵的物质的量为x,硫酸铵的物质的量为y,
根据总质量可得:①80g/mol×x+132/mol×y=21.2g,
再根据生成氨气的物质的量可得:②x+2y=0.3mol,
①②联立解得:x=0.1、y=0.1,
答:样品中NH4NO3和(NH4)2SO4的物质的量各为0.1mol.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

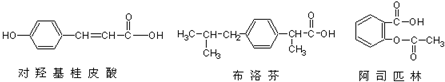
| A. | 三种有机物都能与浓溴水发生反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 将1mol 的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多 | |
| D. | 使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物 |
| 元素代号 | L | M | Q | R | T |
| 原子半径 | 0.160nm | 0.143nm | 0.112nm | 0.104nm | 0.066nm |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 气态氢化物的还原性为H2T>H2R | B. | L2+与R2-的核外电子数相等 | ||
| C. | M与T形成的化合物不具有两性 | D. | 单质与稀盐酸反应的速率为L<Q |
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 氧化产物与还原产物的物质的量之比为1:1 | |
| C. | 该反应说明Cu的金属性很强 | |
| D. | 2mol H2SO4参与反应时,有4 mol电子发生转移 |
| A. | 5n-2 | B. | 3n-12 | C. | 3n-4 | D. | n-10 |
| A. | 苯、乙烯都既能发生加成反应,也能发生氧化反应 | |
| B. | 塑料、橡胶和合成纤维都属于有机高分子化合物 | |
| C. | 淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 | |
| D. | 淀粉、纤维素的通式均为(C6H10O5)n,但它们不互为同分异构体 |
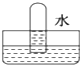
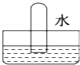
 利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化):
利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化):