题目内容
15.下列事实不能用电化学原理解释的是( )| A. | 铁片在潮湿的环境中生锈 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 银制器皿露置在空气中发黑 | |
| D. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
分析 A.铁片在潮湿的环境中形成原电池;
B.加锌后,金属性Zn>Fe,Zn易被腐蚀;
C.纯银的器皿能和硫化氢反应而发生化学反应;
D.滴少量硫酸铜,置换出Cu,构成原电池;
解答 解:A.铁片在潮湿的环境中形成原电池而被腐蚀生锈,故A不选;
B.加锌后,金属性Zn>Fe,构成原电池,Zn易被腐蚀,故B不选;
C.纯银中只含银一种金属,和电解质溶液不能形成原电池,银和硫化氢发生化学反应而生成黑色的硫化银,故C选;
D.滴少量硫酸铜,置换出Cu,构成原电池,加快反应速率,故D不选;
故选C.
点评 本题考查原电池,明确发生的化学反应及电化学反应为解答本题的关键,注意原电池中负极易被腐蚀,题目难度不大.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
5.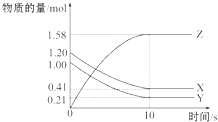 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )| A. | 从反应开始到10 s时,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 10s后,该反应停止进行 | |
| C. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) | |
| D. | 从反应开始到10 s时,平均反应速率v(X)=v(Y)=0.039 5 mol•L-1•s-1 |
6.下列各组物质中,一定互为同系物的一组是( )
| A. | C3H6与C5H10 | B. | C3H8与C5H12 | ||
| C. | 分子式为CH4O和C2H6O的物质 | D. | 苯酚和苯甲醇(C6H5CH2OH) |
3.运用元素周期律分析下列推断,其中错误的是( )
| A. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 硫酸锶难溶于水 |
10.下列物质中,属于共价化合物的是( )
| A. | Cl2 | B. | NH4Cl | C. | H2O | D. | KOH |
7. 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如图所示,则下列说法错误的是( )| A. | 反应的化学方程式是X+2Y?2Z | |
| B. | 该反应在0-3min时间内产物Z的平均反应速率 0.083mol•L-1•min-1 | |
| C. | 该反应达到平衡时反应物X的转化率α等于45% | |
| D. | 其他条件不变,升高温度,若正反应速率增大,则逆反应速率将减小 |
4.下列对反应2H2SO4+Cu→CuSO4+SO2↑+2H2O的说法中正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 氧化产物与还原产物的物质的量之比为1:1 | |
| C. | 该反应说明Cu的金属性很强 | |
| D. | 2mol H2SO4参与反应时,有4 mol电子发生转移 |
5.下列有关化学用语的说法中正确的是( )
| A. | -OH与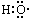 都表示羟基 都表示羟基 | B. | 聚丙烯的结构简式: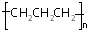 | ||
| C. | CH4分子的比例模型: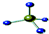 | D. | 次氯酸分子的电子式: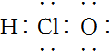 |