题目内容
14.磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物有着广泛的应用.(1)2P(s)+3Cl2(g)═2PCl3(g)△H=-612kJ/mol
P(s)+5/2Cl2(g)═PCl5(g)△H=-399kJ/mol
写出PCl5分解成PCl3和Cl2的热化学方程式是PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1.
(2)PCl5分解成PCl3和Cl2的反应是可逆反应.T℃时,向2.0L恒容密闭容器中充入1.0mol PCl5,经过250s达到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
分析 (1)根据由①2P(s)+3Cl2(g)═2PCl3(g)△H=-612kJ/mol
②P(s)+5/2Cl2(g)═PCl5(g)△H=-399kJ/mol
则根据盖斯定律(①-②×2)×$\frac{1}{2}$计算得到;
(2)由表中数据可知50~150s内,△n(PCl3)=0.19-0.16=0.03mol,根据v=$\frac{△c}{△t}$计算.
解答 解:(1)由①2P(s)+3Cl2(g)═2PCl3(g)△H=-612kJ/mol
②P(s)+5/2Cl2(g)═PCl5(g)△H=-399kJ/mol
则(①-②×2)×$\frac{1}{2}$得PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1,故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1;
(2)由表中数据可知50~150s内,△n(PCl3)=0.19-0.16=0.03mol,v(PCl3)=$\frac{\frac{0.03mol}{2L}}{100s}$=1.5×10-4mol/(L•s),故答案为:1.5×10-4mol/(L•s).
点评 本题考查热化学方程式的书写以及盖斯定律的应用以及反应速率的计算,题目难度不大,注意正确理解并运用盖斯定律,注意热化学方程式的书写方法.

练习册系列答案
相关题目
4.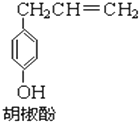 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应;
⑤该化合物可与NaOH和Na2CO3发生反应.其中正确的是( )
 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法:①该化合物属于芳香烃;
②分子中至少有7个碳原子处于同一平面;
③它的部分同分异构体能发生银镜反应;
④1mol该化合物最多可与2molBr2发生反应;
⑤该化合物可与NaOH和Na2CO3发生反应.其中正确的是( )
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ③④⑤ |
5.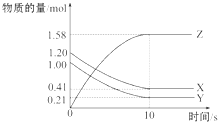 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述中正确的是( )| A. | 从反应开始到10 s时,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 10s后,该反应停止进行 | |
| C. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) | |
| D. | 从反应开始到10 s时,平均反应速率v(X)=v(Y)=0.039 5 mol•L-1•s-1 |
2.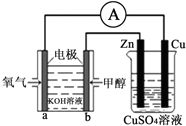 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )
 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一.利用甲醇燃料电池设计如图所示的装置,则下列说法中不正确的是( )| A. | 该装置中Cu极为阳极 | |
| B. | 该装置中右池为电镀池,电解过程中CuSO4溶液pH不变 | |
| C. | b极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为1.12L |
9.某实验小组对甲、乙、丙、丁四种固体样品的性质进行测试,结果如下表:
则这四种固体物质中最可能是有机物的是( )
| 物质性质 | 甲 | 乙 | 丙 | 丁 |
| 熔点 | 低 | 高 | 高 | 低 |
| 水溶性 | 不溶 | 溶 | 不溶 | 溶 |
| 高温 | 分解 | 稳定 | 稳定 | 稳定 |
| 导电性 | 不导电 | 导电 | 不导电 | 导电 |
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
19.下列三种有机物是某些药物中的有效成分.以下说法正确的是( )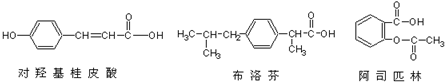

| A. | 三种有机物都能与浓溴水发生反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 将1mol 的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多 | |
| D. | 使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物 |
6.下列各组物质中,一定互为同系物的一组是( )
| A. | C3H6与C5H10 | B. | C3H8与C5H12 | ||
| C. | 分子式为CH4O和C2H6O的物质 | D. | 苯酚和苯甲醇(C6H5CH2OH) |
3.运用元素周期律分析下列推断,其中错误的是( )
| A. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 硫酸锶难溶于水 |
4.下列对反应2H2SO4+Cu→CuSO4+SO2↑+2H2O的说法中正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 氧化产物与还原产物的物质的量之比为1:1 | |
| C. | 该反应说明Cu的金属性很强 | |
| D. | 2mol H2SO4参与反应时,有4 mol电子发生转移 |