题目内容
15.用NA表示阿伏加得罗常数,下列说法不正确的是( )| A. | 对于Si+O2═SiO2,每当新形成2NA个Si-O键,需要断开NA个Si-Si键 | |
| B. | 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA | |
| C. | 次氯酸光照分解产生22.4mL气体(标准状况)转移的电子数为0.002NA | |
| D. | 电解精炼铜时,若阴极析出32g铜,则转移的电子数为NA |
分析 A、1mol二氧化硅中含有4mol硅氧键,形成2NA个Si-O键,形成了0.5mol二氧化硅,需要0.5mol硅原子,再根据硅晶体的空间结构计算出需要断裂Si-Si键数目;
B、熔融的NaHSO4中含有的阳离子只有钠离子;
C、发生反应2HClO=2HCl+O2,产生的气体为HCl、O2,根据n=$\frac{V}{Vm}$计算混合气体的物质的量,进而计算氧气的物质的量,反应中氧元素化合价由-2价升高为0价,据此计算转移电子物质的量,再根据N=nNA计算转移电子数目;
D、粗铜中含有杂质铁、锌等较活泼金属,电解过程中铁、锌优先放电.
解答 解:A、对于Si+O2=SiO2,每当形成2NA个Si-O键,需要形成0.5mol二氧化硅,反应消耗了0.5mol硅原子;由于1mol硅原子形成了4个共价键,根据均摊法,1mol硅原子形成了2molSi-Si键,所以反应0.5mol硅需断开1mol硅硅键,即断裂NA个Si-Si键,故A正确;
B、12.0g熔融的NaHSO4的物质的量为0.1mol,0.1mol熔融硫酸氢钠电离出0.1mol钠离子和0.1mol硫酸氢根离子,所以含有的阳离子数为0.1NA,故B正确;
C、发生反应2HClO=2HCl+O2,产生的气体为HCl、O2,生成混合气体的物质的量为$\frac{0.0224L}{22.4L/mol}$=0.001mol,故生成氧气的物质的量为0.001mol×$\frac{1}{3}$,反应中氧元素化合价由-2价升高为0价,故转移电子数目为0.001mol×$\frac{1}{3}$×4×NAmol-1=0.0013NA,故C错误;
D、电解精炼铜时,阴极反应:Cu2++2e-=Cu,所以当阴极质量增重32g即析出0.5mol铜时,转移的电子的物质的量为1mol,则阴极得到的电子数为NA,故D正确;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 溶液的体积10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 | |
| C. | 若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
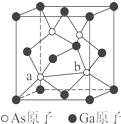 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.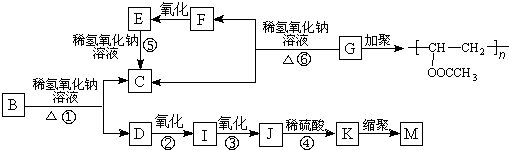
 .
.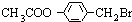 +3NaOH
+3NaOH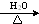 CH3COONa+
CH3COONa+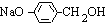 +NaBr+H2O.
+NaBr+H2O.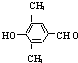 、
、 .
.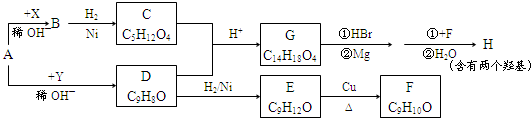
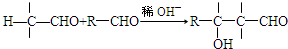
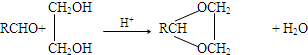
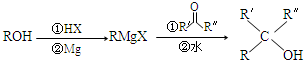
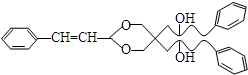
 .X与苯酚生成高聚物反应的化学方程式
.X与苯酚生成高聚物反应的化学方程式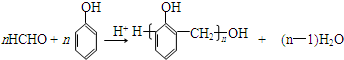 .
. .
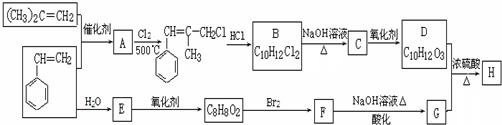
.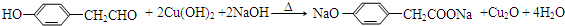 .
.
 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$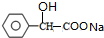 +NaBr+H2O.
+NaBr+H2O.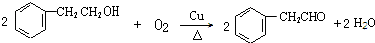 .
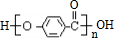
.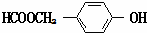 (写结构简式).
(写结构简式).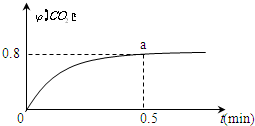 常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示: