题目内容
将1.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,一定条件下发生反应:PCl3(g)+ Cl2(g) PCl5(g),达到平衡时PCl5为0.3mol·L-1,如果此时再充入1.0 molPCl3和1.0 mol Cl2,在相同温度下再达到平衡时,PCl5的物质的量浓度是
PCl5(g),达到平衡时PCl5为0.3mol·L-1,如果此时再充入1.0 molPCl3和1.0 mol Cl2,在相同温度下再达到平衡时,PCl5的物质的量浓度是
| A.0.6mol·L-1 | B.大于0.3 mol·L-1,小于0.6 mol·L-1 |
| C.大于0.6 mol·L-1 | D.小于0.3 mol·L-1 |
C
解析试题分析:根据PV=nRT知,R为常数,当V、T相同时,n越大,P越大;该反应是气体体积减小的反应,4mol>2mol,则增大压强,平衡向气体体积减小的方向移动,即正反应方向移动,所以导致反应达到平衡时PCl5的浓度在原平衡2倍的基础上增大,PCl5的浓度大于0.6 mol·L-1 。
考点:化学平衡的影响因素

练习册系列答案
相关题目
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
| A.加压 | B.升温 | C.增大水蒸气浓度 | D.增大碳的物质的量 |
下列说法正确的是
| A.放热反应一定都是自发的 |
| B.电解池的反应属于自发过程 |
| C.反应能否自发进行与温度有关 |
| D.能自发进行的化学反应,一定是△H>0、△S>0 |
某温度下,X(g)+Y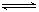 2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
2Z反应达到平衡,在升高温度或减小压强的情况下,平衡均向右移动,则下列有关反应的各种叙述中正确的是
| A.正反应是吸热反应,Z是固体 |
| B.逆反应是放热反应,Y是固体,Z为气体 |
| C.正反应是吸热反应,只有Z不是气体 |
| D.正反应是放热反应,Y和Z均为气体 |
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3,的浓度为
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
下列说法正确的是
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大,原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
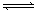 2AB3(g) △H<0(正反应放热),下列图像(其中W为质量分数)不正确的是 ( )
2AB3(g) △H<0(正反应放热),下列图像(其中W为质量分数)不正确的是 ( )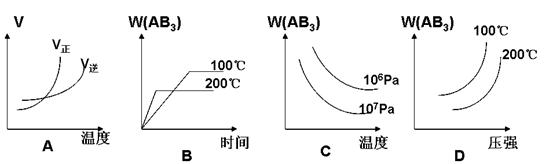
 B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时c(A)/c(B)=b,下列叙述正确的是 ( )
B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时c(A)/c(B)=b,下列叙述正确的是 ( )