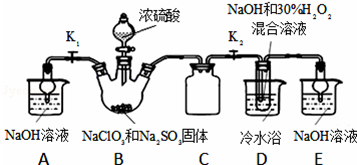
题目内容
8.用化学用语填空:(1)在通空气的条件下煅烧铬铁矿(主要成分可表示为FeO•Cr2O3)和NaOH的固体混合物生成Na2CrO4和NaFeO2反应的化学方程式是4FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O.
(2)K2FeO4为高效绿色净水剂,可通过Fe(OH)3与KOH和Cl2反应制得.该反应的化学方程式是10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O.
(3)向1L1mol/LFeI2溶液中通入28L(标况)氯气(写离子方程式):2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-.
分析 (1)反应物为:FeO•Cr2O3、NaOH和7O2,生成物为:Na2CrO4、NaFeO2和H20,配平即可;
(2)Cl2与Fe(OH)3在强碱性条件下反应制得K2FeO4,Fe元素的化合价升高,则Cl元素的化合价降低,结合电子、电荷守恒解答;
(3)还原性:I->Fe2+>Br->Cl-,根据氯气与碘离子的物质的量判断过量情况书写离子反应方程式.
解答 解:(1)反应物为:FeO•Cr2O3、氢氧化钠和氧气,生成物为:铁从+2升到+3,铬从+3升到+6,2个铬升高6价,共升高7价,氧气化合价从0价降低到-2价,共降低4价,所以初步配平为:4FeO•Cr2O3+7O2+NaOH→8Na2CrO4+4NaFeO2,根据原子守恒,氢氧化钠前系数为20,生成物还有10H2O,配平方程式得:4FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O,
故答案为:4FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O;
(2)Cl2与Fe(OH)3在强碱性条件下反应制得K2FeO4,Fe元素的化合价升高,则Cl元素的化合价降低,由电子、电荷守恒可知,反应方程式为:10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O,
故答案为:10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O;
(3)28L(标况)Cl2的物质的量为$\frac{28L}{22.4L/mol}$=1.25mol,1L 1mol/L的FeI2溶液中含有1mol亚铁离子和2mol碘离子,碘离子还原性强于亚铁离子,碘离子优先与氯气反应,2mol碘离子需要消耗1mol氯气,显然氯气过量,溶液中发生氯气与碘离子的反应,氯气与二价铁的反应,所以反应的离子方程式为:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-,
故答案为:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-.
点评 本题考查反应方程式的书写,为高考中的经典题型,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,注意电子、电荷守恒的应用,题目难度中等.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案| A. | 质量为8.4g | B. | 物质的量为2 mol | ||
| C. | 体积为4.48 L | D. | 原子数目为0.56NA |
| A. | 加适量6mol•L-1HCl溶液 | B. | 加数滴CuCl2溶液 | ||
| C. | 加适量NaNO3溶液 | D. | 加适量NaCl溶液 |
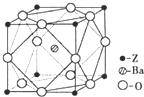 Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素.已知:
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素.已知: