题目内容
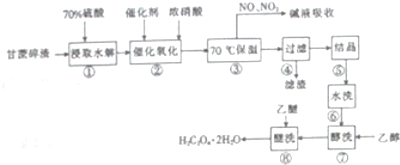
16.铵明矾[(NH4)xAly(SO4)m•nH2O]为无色、透明晶体.工业常用于制造颜料、媒染剂、净水剂等.制取铵明矾的工艺流程图如下:
(1)25℃时,将0.2mol•L-1的氨水与0.1mol•L-1的H2SO4溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈1×10-5.(忽略混合时溶液体积的变化)
(2)铵明矾的化学式可通过下列实验测定:准确称取4.53g铵明矾配成溶液,加入盐酸酸 化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色沉淀4.66g.另取4.53g铵明矾,配制成250.00mL溶液.准确量取25.00mL 溶液,调节溶液pH约为3.5,加入30.00mL 0.0500mol•L-1乙二胺四乙酸二钠(Na2H2Y)标准溶液,加热至沸,使Al3+与Na2H2Y的反应迅速定量进行;待反应完成后调节溶液为5~6,加入二甲酚橙指示剂,再用0.0500mol•L-1Zn2+滴定液返滴定过量的Na2H2Y,至滴定终点消耗Zn2+滴定液10.00mL.反应的离子方程式为:Al3++H2Y2-═AlY-+2H+,Zn2++H2Y2-═ZnY2-+2H+
①若返滴定时,滴定管在使用前未用Zn2+滴定液润洗,测得的Al3+含量将偏低(填“偏高”、或“偏低”或“不变”);
②调节溶液pH约为3.5的目的是抑制Al3+水解;
③通过计算确定铵明矾的化学式(写出计算过程)..
分析 氧化铝和硫酸反应生成硫酸铝和水,硫酸铝和氨水反应生成铵明矾,结晶析出铵明矾;
(1)将0.2mol•L-1的氨水与0.1mol•L-1的H2SO4溶液等体积混合,二者恰好反应生成硫酸铵,生成硫酸铵的浓度为:0.05mol/L,铵根离子水解生成一水合氨和氢离子,水解反应方程式为:NH4++H2O?NH3•H2O+H+,所得溶液的pH=5,则c(H+)=10-5,c(NH3•H2O)=c(H+)=10-5,c(OH-)=$\frac{1×1{0}^{-14}}{1{0}^{-5}}$=1×10-9,c(NH4+)=0.1-10-5,K=$\frac{c(N{H}_{{4}^{+}})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,代入数据计算;
(2)①若返滴定时,滴定管在使用前未用Zn2+滴定液润洗,导致锌离子浓度偏低,所用体积偏大,据此分析对铝离子浓度的影响;
②调节pH抑制铝离子水解;
③根据白色沉淀4.66g计算出硫酸根离子的物质的量,根据滴定结果计算出铝离子的物质的量,根据电荷守恒计算出铵根离子物质的量,根据质量守恒计算出水的物质的量,计算出铵明矾各种成分的物质的量之比,就是铵明矾的化学式
解答 解:(1)将0.2mol•L-1的氨水与0.1mol•L-1的H2SO4溶液等体积混合,二者恰好反应生成硫酸铵,生成硫酸铵的浓度为:0.05mol/L,铵根离子水解生成一水合氨和氢离子,水解反应方程式为:NH4++H2O?NH3•H2O+H+,所得溶液的pH=5,则c(H+)=10-5,c(NH3•H2O)=c(H+)=10-5,c(OH-)=$\frac{1×1{0}^{-14}}{1{0}^{-5}}$=1×10-9,c(NH4+)=0.1-10-5,K=$\frac{c(N{H}_{{4}^{+}})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{(0.1-1{0}^{-5})×1{0}^{-9}}{1{0}^{-5}}$=1×10-5,故答案为:1×10-5;
(2)①若返滴定时,滴定管在使用前未用Zn2+滴定液润洗,导致锌离子浓度偏低,所用体积偏大,据此计算出未和铝离子反应的乙二胺四乙酸二钠溶液偏多,和铝离子反应的乙二胺四乙酸二钠偏少,由此计算的铝离子浓度偏低;故答案为:偏低;
②本实验是用乙二胺四乙酸二钠滴定铝离子,调节pH为3.5,酸性条件下抑制了铝离子的水解,保证所有铝离子和乙二胺四乙酸二钠反应,故答案为:抑制Al3+水解;
③n(铵明矾)=4.53g÷453g/mol=0.01mol,n(SO42-)=n(BaSO4)=4.66g÷233g/mol=0.02mol,
n(Al3+)=250mL÷25mL×0.0500mol/L×(30.00-10.00)×10-3L=0.01mol,
由电荷守恒知:n(NH4+)=2n(SO42-)-3n(Al3+)=0.02mol×2-0.01mol×3=0.01mol
n(H2O)=(4.53-0.02×96-0.01×27-0.01×18)g÷18g/mol=0.12mol,
所以n(Al3+):n(NH4+):n(SO42-):n(H2O)=0.01mol:0.01mol:0.02mol:0.12mol=1:1:2:12,
铵明矾的化学式为:NH4Al(SO4)2•12H2O,
答:铵明矾的化学式为NH4Al(SO4)2•12H2O.
点评 本题考查了制取铵明矾的流程,涉及的内容不多,但是计算量稍大,计算电离常数要根据电离平衡常数表达式计算出各离子浓度,带入数据即可,计算铵明矾分子式时要明确测定原理,根据电荷守恒、质量守恒计算出各组成成分的物质的量,本题难度较大.

| A. | ③④ | B. | ①③ | C. | ①② | D. | ①③④ |
| 选项 | 实验内容 | 结论 |
| A | 某物质的水溶液能使红色石蕊试纸变蓝 | 该物质一定是氨气 |
| B | 某物质的水溶液中加入盐酸产生无色无味气体 | 该溶液一定含有大量碳酸根离子 |
| C | 测定同浓度Na2CO3 和Na2SO4 溶液的pH,前者大于后者 | 碳元素非金属性弱于硫 |
| D | 向沸水中逐滴加入1~2mL FeCl3饱和溶液,搅拌并继续煮沸出现浑浊 | 制备Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
| A. | SO2氧化性比I2强 | |
| B. | 还原性:I->SO2>Cl- | |
| C. | Cl2能氧化I-和SO2 | |
| D. | 最后溶液中溶液一定含有Cl-、SO42-和I2 |
| A. | 矿泉水 | B. | 蒸馏水 | C. | NaCl溶液 | D. | 空气 |