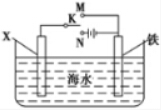
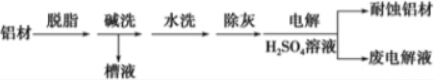
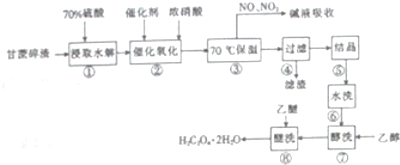
题目内容
10.在一定体积0.005mol/LBa(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.假设反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是1:4.分析 0.005mol/L Ba(OH)2溶液中含有氢氧根离子的浓度为0.01mol/L,pH=1的溶液中氢氧根离子浓度为0.001mol/L;
溶液中的Ba2+恰好完全沉淀,发生反应:Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,由方程式可知氢氧化钡的物质的量等于反应生成氢氧化钠的物质的量,据此计算Ba(OH)2溶液体积与反应后溶液体积关系,进而计算Ba(OH)2溶液和NaHSO4溶液体积之比.
解答 解:溶液中的Ba2+恰好完全沉淀,发生反应为:Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,由方程式可知氢氧化钡的物质的量等于反应生成氢氧化钠的物质的量,
0.005mol/L Ba(OH)2溶液中含有氢氧根离子的浓度为0.01mol/L,pH=1的溶液中氢氧根离子浓度为0.001mol/L,
设氢氧化钡溶液体积为aL,混合后溶液体积为bL,
则:$\frac{1}{2}$×0.01mol/L×aL=0.001mol/L×bL,
解得:b=5a,
则NaHSO4溶液体积为:5aL-aL=4aL,
故Ba(OH)2溶液和NaHSO4溶液体积之比为aL:4aL=1:4,
故答案为:1:4.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确明确发生的反应判断氢氧化钡与氢氧化钠物质的量相等为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法.

练习册系列答案
相关题目
1.下列离子方程式中书写不正确的是( )
| A. | 大理石与盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 二氧化硅与苛性钠溶液反应:SiO2+2OH-=SiO${\;}_{3}^{2-}$+H2O | |
| D. | 澄清石灰水通入过量CO2的总反应:CO2+OH-=HCO${\;}_{3}^{-}$ |
18.根据下列实验内容得出的结论正确的是( )
| 选项 | 实验内容 | 结论 |
| A | 某物质的水溶液能使红色石蕊试纸变蓝 | 该物质一定是氨气 |
| B | 某物质的水溶液中加入盐酸产生无色无味气体 | 该溶液一定含有大量碳酸根离子 |
| C | 测定同浓度Na2CO3 和Na2SO4 溶液的pH,前者大于后者 | 碳元素非金属性弱于硫 |
| D | 向沸水中逐滴加入1~2mL FeCl3饱和溶液,搅拌并继续煮沸出现浑浊 | 制备Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
5.下列表示物质的化学用语正确的是( )
| A. | 葡萄糖的分子式:C6H12O6 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 14C的原子结构示意图: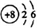 | D. | 氯气的电子式:Cl:Cl |
9.有关合金的性质叙述不正确的是( )
| A. | 合金的熔点比它的各成分的熔点低 | B. | 合金一定是金属熔合而成 | ||
| C. | 合金的硬度和强度一般比纯金属高 | D. | 硬铝、黄铜、钢均为合金 |