题目内容
6.NA表示阿伏加德罗常数,下列判断正确的是( )| A. | 在18g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L水中含有2NA个氢原子 | |
| C. | 1mol.L-1NaCl阴离子数为NA | |
| D. | 含NA个Na+的NaOH溶解于lL水中,Na+的物质的量浓度为1mol•L-1 |
分析 A、18O2由18O原子构成,而18O原子的摩尔质量为18g/mol;
B、标况下,水为液态;
C、溶液体积不明确;
D、含NA个Na+的NaOH溶解于lL水中,溶液体积大于1L.
解答 解:A、18O2由18O构成,而18O的摩尔质量为18g/mol,故18g18O2中18O原子的物质的量n=$\frac{18g}{18g/mol}$=1mol,个数为NA个,故A正确;
B、标况下,水为液态,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、溶液体积不明确,溶液中阴离子的个数无法计算,故C错误;
D、含NA个Na+的NaOH溶解于lL水中,溶液体积大于1L,则钠离子的浓度小于1mol/L,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
5.无论在化学实验室还是在家中进行实验或探究活动,都必须注意安全.下列实验操作正确的是( )
| A. | 不慎将酒精洒到桌面上引起着火,应立即用较多的水浇灭 | |
| B. | 为防止试管破裂,加热固体时试管口一般要略低于试管底 | |
| C. | 白磷在空气中易自燃,用剩的白磷可倒入垃圾箱 | |
| D. | 蒸馏时为防止液体暴沸可在蒸馏烧瓶中加入少量沸石 |
17.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 用玻璃棒蘸取某溶液做焰色反应,可看到黄色火焰 | 溶液中一定有Na+ |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| D | 向某溶液中加稀盐酸无现象,再加入BaCl2溶液,生成白色沉淀 | 该溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
11.下列实验操作与相对应实验目的正确的是
( )
| 实验操作 | 实验目的 | |
| A | C2H4与SO2混合气体通过盛有溴水的洗气瓶 | 除去C2H4中的SO2 |
| B | 制乙炔时用饱和食盐水代替水 | 减慢化学反应速率 |
| C | 淀粉溶液水解后冷却至室温,加碘水观察现象 | 检验淀粉是否完全水解 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
18.下列反应过程会放出热量且既属于氧化还原反应,又属于离子反应的是( )
| A. | 甲烷在氧气中的燃烧反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 铝与稀盐酸的反应 |
16.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是内层电子总数的一半,Y的二价阴离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法正确的是( )
| A. | Z是酸性氧化物 | B. | Z的水化物是碱 | ||
| C. | Z的化学式为X2Y | D. | Z的水化物的酸性强于硫酸 |
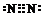 .
. Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.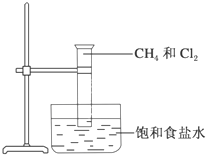 如图是研究甲烷取代反应实验装置图,具体的实验方法是:
如图是研究甲烷取代反应实验装置图,具体的实验方法是:
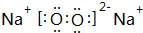 、
、 .
.