题目内容
5.无论在化学实验室还是在家中进行实验或探究活动,都必须注意安全.下列实验操作正确的是( )| A. | 不慎将酒精洒到桌面上引起着火,应立即用较多的水浇灭 | |
| B. | 为防止试管破裂,加热固体时试管口一般要略低于试管底 | |
| C. | 白磷在空气中易自燃,用剩的白磷可倒入垃圾箱 | |
| D. | 蒸馏时为防止液体暴沸可在蒸馏烧瓶中加入少量沸石 |
分析 A.从灭火的原理和方法入手,寻找最合适的答案;
B.对试管内固体物质加热时,注意对试管的保护,防止试管炸裂,还需考虑因操作不当而造成意外;
C.白磷的着火点较低,为40℃;
D.为防止液体暴沸可加入沸石.
解答 解:A.不慎将酒精洒到桌面上引起着火,应立即用湿抹布盖灭,故A错误;
B.在对试管内的固体药品加热时,固体药品存放时因受潮而含有少量水或受热时生成的水会在管口液化为液体,此时如果试管口高于试管底部,水则会流向试管底(倒流),而使试管受热不均匀而炸裂,故B正确;
C.白磷在空气中易自燃,用剩的白磷倒入垃圾箱会引发火灾,故C错误;
D.加热仪器中的液体时(如蒸馏或分馏),为防止液体暴沸可在蒸馏烧瓶中加入少量沸石,故D正确.
故选BD.
点评 本题考查化学实验基本操作,题目难度不大,注意白磷在空气中易自燃,化学实验要严格遵守操作规程,否则会造成不良后果或危险,有利于培养学生的安全意识和严谨的实验态度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.近年来江苏省酸雨发生率一直较高.下列物质能导致酸雨的是( )
| A. | CO2 | B. | NH3 | C. | NO2 | D. | CH4 |
20.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,D单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
| A. | 元素A的原子核外有2个电子 | |
| B. | 工业上常用电解C的盐溶液的方法制备元素C的单质 | |
| C. | 在所有非金属的氢化物中,元素E的气态氢化物最稳定 | |
| D. | 元素C的最高价氧化物对应的水化物的碱性比D的强 |
17.某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH${\;}_{4}^{+}$(aq)+$\frac{2}{3}$O2(g)═NO${\;}_{2}^{-}$(aq)+2H+(aq)+H2O(l)△H=-273kJ/mol
②NO${\;}_{2}^{-}$(aq)+$\frac{1}{2}$O2(g)═NO${\;}_{3}^{-}$(aq) H=-73kJ/mol
下列说法正确的是( )
①NH${\;}_{4}^{+}$(aq)+$\frac{2}{3}$O2(g)═NO${\;}_{2}^{-}$(aq)+2H+(aq)+H2O(l)△H=-273kJ/mol
②NO${\;}_{2}^{-}$(aq)+$\frac{1}{2}$O2(g)═NO${\;}_{3}^{-}$(aq) H=-73kJ/mol
下列说法正确的是( )
| A. | 1mol的NH3和1mol的NH4+都有10×6.02×1023个质子 | |
| B. | 室温下,NH4NO2溶液呈酸性,则说明Ka(HNO2)<Kb(NH3•H2O) | |
| C. | NH4+(aq)+2O2(g)═NO3-(aq)+2H+(aq)+H2O(l);△H=-346kJ/mol | |
| D. | 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
5.某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如图所示:
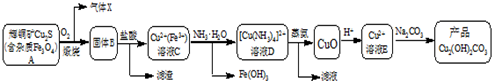
已知:[Cu(NH3)4]2+(aq)═Cu2+(aq)+4NH3(aq)根据以上工艺流程,下列说法不正确的是( )

已知:[Cu(NH3)4]2+(aq)═Cu2+(aq)+4NH3(aq)根据以上工艺流程,下列说法不正确的是( )
| A. | 气体X中含有SO2 | |
| B. | 为实现溶液C到溶液D的转化,加NH3•H2O至红棕色沉淀刚好完全,过滤即可 | |
| C. | 蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4]Cl2+H2O$\frac{\underline{\;加热\;}}{\;}$CuO+2HCl↑+4NH3↑ | |
| D. | 在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低 |
6.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 在18g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L水中含有2NA个氢原子 | |
| C. | 1mol.L-1NaCl阴离子数为NA | |
| D. | 含NA个Na+的NaOH溶解于lL水中,Na+的物质的量浓度为1mol•L-1 |

 反应A(g)?B(g)+C(g)在容积为2.0L的密闭容器中进行,初始时加入0.10mol A.温度T1和T2下,A的浓度与时间关系如图所示.
反应A(g)?B(g)+C(g)在容积为2.0L的密闭容器中进行,初始时加入0.10mol A.温度T1和T2下,A的浓度与时间关系如图所示.