题目内容
14.某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质,当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用.(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为
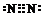 .
.(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为Fe(已知该反应为置换反应).
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为2NaHCO3
 Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.(4)100g上述产气药剂产生的气体通过碱石灰后得到N233.6L(标准状况).
①用碱石灰除去的物质为CO2、H2O;
②该产气药剂中NaN3的质量分数为65%.
分析 (1)N2是非极性分子,分子内氮与氮之间存在三个电子对;
(2)置换反应的反应物和产物均为单质和化合物,故Fe2O3与Na发生置换反应的产物是Fe和Na2O,结合氧化还原反应的理论,很容易判断出还原产物;
(3)NaHCO3不稳定,受热易分解,生成稳定的Na2CO3、H2O、CO2;
(4)①碱石灰易吸水和二氧化碳,反应中恰好有这二种物质生成;
②N233.6L,其物质的量为1.5mol,结合原子守恒可得NaN3的物质的量为1mol,NaN3的质量为65克,气药剂的质量分数为65%.
解答 解:(1)N2是非极性分子,分子内氮与氮之间存在三个电子对,电子式为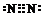 ,故答案为:
,故答案为: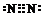
(2)置换反应的反应物和产物均为单质和化合物,故Fe2O3与Na发生置换反应的产物是Fe和Na2O,Fe为Fe2O3得电子后的产物,为还原产物,故答案为:Fe;
(3)NaHCO3不稳定,受热易分解,生成稳定的Na2CO3、H2O、CO2,反应方程式为2NaHCO3  Na2CO3+CO2↑+H2O(2分),故答案为:2NaHCO3
Na2CO3+CO2↑+H2O(2分),故答案为:2NaHCO3  Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(4)①气药剂反应生成的混合气体为H2O、CO2、N2,碱石灰恰好能吸收水和二氧化碳,故答案为:CO2、H2O;
②33.6LN2的物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,化学反应过程中遵守氮原子守恒,可知NaN3的物质的量为$\frac{1.5mol×2}{3}$=1mol,NaN3的质量为1mol×65g/mol=65g,气药剂中NaN3的质量分数为$\frac{65g}{100g}$×100%=65%,故答案为:65%.
点评 考查了氮气的电子式书写,氧化还原反应的理论与分析,碳酸钠的不稳定性,物质的量与质量、气体摩尔体积之间的计算,以及原子守恒等,中等难度.

| A. | CO2 | B. | NH3 | C. | NO2 | D. | CH4 |
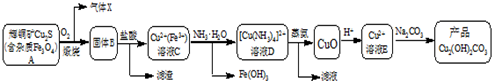
已知:[Cu(NH3)4]2+(aq)═Cu2+(aq)+4NH3(aq)根据以上工艺流程,下列说法不正确的是( )
| A. | 气体X中含有SO2 | |
| B. | 为实现溶液C到溶液D的转化,加NH3•H2O至红棕色沉淀刚好完全,过滤即可 | |
| C. | 蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4]Cl2+H2O$\frac{\underline{\;加热\;}}{\;}$CuO+2HCl↑+4NH3↑ | |
| D. | 在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低 |
| A. | 在18g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L水中含有2NA个氢原子 | |
| C. | 1mol.L-1NaCl阴离子数为NA | |
| D. | 含NA个Na+的NaOH溶解于lL水中,Na+的物质的量浓度为1mol•L-1 |
| A. | 元素的种类由原子核内质子数决定 | |
| B. | 分子的种类由分子组成决定 | |
| C. | 原子的种类由原子核内中子数决定 | |
| D. | 元素的化学性质由原子最外层电子数决定 |
| A. | 1mol氯气参加反应转移的电子数一定为2NA | |
| B. | 常温下10LpH=13的NaOH溶液中含有的OH-数目约为NA | |
| C. | 将0.1mol氯化铁溶于1L水中,所得溶液含有Fe3+数目为0.1NA | |
| D. | 电解法精炼铜时,当阳极有64g铜溶解,导线上流过电子数目为2NA |
 (1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上没有(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上有 (填“有”或“没有”)气泡产生.
(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上没有(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上有 (填“有”或“没有”)气泡产生.