题目内容
1.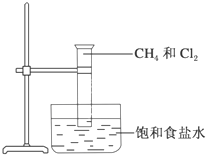 如图是研究甲烷取代反应实验装置图,具体的实验方法是:
如图是研究甲烷取代反应实验装置图,具体的实验方法是:(1)若研究甲烷与氯气的取代反应,还需要的条件是光照.
(2)二氯甲烷有1种同分异构体
(3)请完成一氯甲烷与氯气发生取代反应的化学方程式CH3Cl+Cl2$\stackrel{光}{→}$
CH2Cl2+HCl
(4)在实验室可以用下列哪种常见试剂除去甲烷中混有的少量乙烯气体D
A.盐酸 B.水 C.酒精 D.溴的四氯化碳溶液.
分析 (1)CH4与Cl2反应需光照条件;
(2)二氯甲烷无同分异构体;
(3)CH4与Cl2在光照条件下能生成CH3Cl和HCl,CH3Cl能继续和氯气取代生成二氯甲烷和HCl;
(4)除去甲烷中混有的少量乙烯时注意不能引入新的杂质,并且不能减少甲烷的量.
解答 解:(1)CH4与Cl2反应需光照条件下进行,故答案为:光照;
(2)由于甲烷为正四面体结构,而二氯甲烷是用两个氯原子取代了甲烷中的两个-H原子,故只有一种结构,无同分异构体,故答案为:1;
(3)CH4与Cl2在光照条件下能生成CH3Cl和HCl,CH3Cl能继续和氯气取代生成 CH2Cl2和HCl,故化学方程式为:CH3Cl+Cl2$\stackrel{光}{→}$ CH2Cl2+HCl,故答案为:CH2Cl2;
(4)A.甲烷和乙烯都不与盐酸溶液反应,故A错误;
B.甲烷和乙烯都不溶于水,故B错误;
C.甲烷和乙烯均能溶于酒精,故C错误;
D.因为甲烷不和溴的四氯化碳溶液反应,而乙烯能和溴的四氯化碳发生加成反应且生成的CH2BrCH2Br为液态,便于分离,故D正确;
故选D.
点评 本题考查甲烷的性质和物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,D单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
| A. | 元素A的原子核外有2个电子 | |
| B. | 工业上常用电解C的盐溶液的方法制备元素C的单质 | |
| C. | 在所有非金属的氢化物中,元素E的气态氢化物最稳定 | |
| D. | 元素C的最高价氧化物对应的水化物的碱性比D的强 |
6.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 在18g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L水中含有2NA个氢原子 | |
| C. | 1mol.L-1NaCl阴离子数为NA | |
| D. | 含NA个Na+的NaOH溶解于lL水中,Na+的物质的量浓度为1mol•L-1 |
13.下列关于有机物的鉴别方法正确的是( )
| A. | 用溴水或酸性KMnO4鉴别乙烷和乙烯 | |
| B. | 用溴水或酸性KMnO4鉴别苯和苯的同系物 | |
| C. | 用溴水、FeCl3溶液、酸性KMnO4均可以鉴别苯酚溶液和酒精溶液 | |
| D. | 向卤代烃中先加入NaOH溶液,加热,再加AgNO3生成沉淀,即可根据颜色确定卤素原子的种类 |
 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.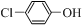 )的废水可以通过构成微生物电池除去,其原理如图所示.①B是电池的负极(填“正”或“负”);②A极的电极反应式为
)的废水可以通过构成微生物电池除去,其原理如图所示.①B是电池的负极(填“正”或“负”);②A极的电极反应式为 -OH+Cl-.
-OH+Cl-. ,该元素在周期表中的位置为第三周期,第ⅣA族,下列不属于晶体硅的用途的是ACD
,该元素在周期表中的位置为第三周期,第ⅣA族,下列不属于晶体硅的用途的是ACD (1)观察图A、B、C,回答下列问题:
(1)观察图A、B、C,回答下列问题: