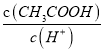题目内容
【题目】(1)请你将反应Cu+2FeCl3==CuCl2+2FeCl2设计成原电池并回答下列问题:
①写出电极反应式:正极_____________________;负极_________________________。
②画出你所设计的原电池简易装置图_________。
(2)该电池向外提供0.2mol 电子,负极材料的质量变化为________________________。
(3)利用反应2Cu+O2+2H2SO4==2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极的反应式为____________________________________________。
【答案】 2Fe3++2e-==2Fe2 Cu- 2e-=Cu2+ 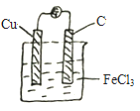 减少6.4g O2+4e-+4H+==2H2O
减少6.4g O2+4e-+4H+==2H2O
【解析】(1)①根据电池总反应式Cu+2FeCl3═CuCl2+2FeCl2可知,Cu失电子作负极,电极反应为:Cu-2e-═Cu2+;正极是三价铁离子得电子生成亚铁离子,电极反应为2Fe3++2e-═2Fe2+,故答案为:2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+;
②根据原电池的总反应,可以选择FeCl3作电解质溶液,选用Cu和 C棒作电极,示意图为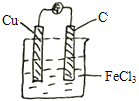 ,故答案为:
,故答案为: ;
;
(2)根据负极反应Cu-2e-=Cu2+可知消耗1mol铜,转移2mol电子,故转移0.2mol电子,消耗的铜为0.1mol,质量为0.1mol×64g/mol=6.4g,故答案为:减少6.4g;
(3)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于电解质溶液显酸性,所以正极的电极反应为:O2+4e-+4H+═2H2O,故答案为:O2+4e-+4H+═2H2O。

 字词句篇与同步作文达标系列答案
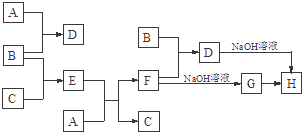
字词句篇与同步作文达标系列答案【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
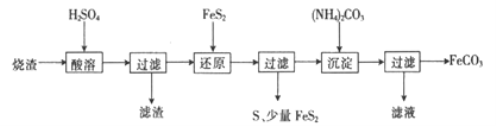
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________