题目内容
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
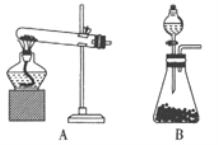
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
(2)支管B的作用是_________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙___________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
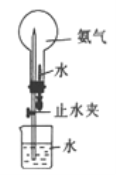
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:_________________________________;
②使用________(填仪器名称)准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
【答案】 CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl 平衡气压,便于恒压滴液漏斗中的液体能够顺利滴下 A ABD 连接好装置,向水准管中注水至液面与量气管中形成高度差,静置一段时间,若高度差不变,则装置不漏气,反之装置漏气 分析天平或电子天平或电光天平 43.20%或0.4320
【解析】(1)利用CaCl2在碱性条件下与H2O2反应制得过氧化钙(CaO2),结合图示产物为过氧化钙晶体,故三颈烧瓶中发生的主要反应的化学方程式为:CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl;(2)支管B的作用是平衡气压,便于恒压滴液漏斗中的液体能够顺利滴下;(3)A、过氧化钙不溶于醇类、乙醚等,选项A可选;B、过氧化钙易与酸反应,选项B不选;C、过氧化钙能潮解,难溶于水,可与水缓慢反应,选项C不选;D、CaCl2溶液中也含有水,而过氧化钙能潮解,难溶于水,可与水缓慢反应,选项D不选;答案选A无水乙醇;(4)A、过氧化钙可与水缓慢反应,可缓慢供氧,选项A正确;B、能吸收鱼苗呼出的CO2气体,反应为:中2CaO2+ 2CO2=2CaCO3+O2,选项B正确;C、过氧化钙加入水中,与潮解无关,选项C错误;D、过氧化钙具有氧化性,可抑菌,选项D正确。答案选ABD;(5)①检查该装置气密性的方法是:连接好装置,向水准管中注水至液面与量气管中形成高度差,静置一段时间,若高度差不变,则装置不漏气,反之装置漏气;②使用分析天平或电子天平或电光天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,根据反应2CaO2![]() 2CaO+ O2↑,则产品中过氧化钙的质量分数为
2CaO+ O2↑,则产品中过氧化钙的质量分数为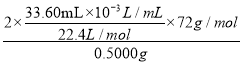 ×100%=43.20%。
×100%=43.20%。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案