题目内容
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还含有一定量的SiO2)可用于制备FeCO3,其流程如下:
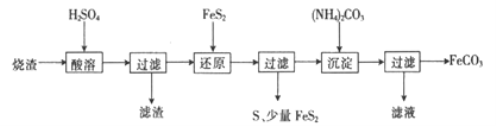
已知:还原时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净的方法是____________
(4)①配平反应的离子方程式: ![]() ____________
____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子 | 离子浓度(mol/L) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.50 |
SO42- | 3.50 | 3.70 |
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为______________
【答案】 FeS2 二氧化硅 取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净。反之,则说明没洗涤干净 2,1,2,3 5:3
【解析】(1)反应Ⅰ方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+。在该反应中,S元素由反应前FeS2中的-1价变为反应后SO42-中的+6价,化合价升高,失去电子,所以FeS2是还原剂,SO42-是氧化产物;(2)烧渣中含Fe2O3、FeO、SiO2,当加入硫酸溶解时,发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,FeO+ H2SO4=FeSO4+H2O,而SiO2是酸性氧化物,不能与硫酸发生反应,仍然以固体的形式存在,所以得到的滤渣主要含有SiO2,名称是二氧化硅;(3)所得FeCO3需充分洗涤,检验FeCO3是否洗净干净只有检验得到的洗涤液中不含有SO42-,就证明洗涤干净了,检验的方法是取少许最后一次洗涤液于试管中,滴加稀盐酸,待无明显现象后,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净。反之,则说明没洗涤干净;(4)①根据电子守恒、电荷守恒,可得配平反应II的离子方程式是:2Fe3++FeS2=2S↓+3Fe2+。②SO42-只有在反应Ⅰ中产生,假设溶液的体积是1L,根据表格数据可知,反应产生的SO42-的物质的量浓度是3.70-3.50=0.20mol,则发生该反应产生的Fe2+的物质的量是1. 5mol,而反应产生的Fe2+的总的物质的量是2.50-0.10=2.40mol,所以反应II中生成Fe2+的物质的量为2.40mol-1. 5mol=0.90mol,故反应Ⅰ、II中生成Fe2+的物质的量之比为1. 5mol:0.90mol=5:3。